ЭЛЕМЕНТЫ СТРУКТУРЫ СМК 4 страница

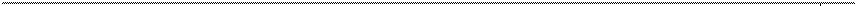
Рис. 11. Процесс производства инфузионного раствора в стеклянных бутылках в форме декомпозиции
 |  |  |  | ||||||
 | |||||||||








 |  |  | |||||||||
 |  |  | |||||||||

 |  |  |  |




 |  |  |  |









Рис. 11. Производство инфузионного раствора в стеклянных бутылках в форме декомпозиции (окончание рисунка)
Таблица 4Т
Матрица ответственности по процессу производства таблетированного препарата
| №№ п/п | Функция | Начальник цеха, участка (сменный мастер) | Оператор смесителя | Оператор гранулятора | Оператор сушилки | Оператор опудривателя | Оператор грохота | Оператор таблеточной машины | Оператор упаковочной машины | Рабочий | Уборщик |
| Планирование и организация производства: подготовка сменного задания; подготовка маршрутных карт и других регистрационных документов досье на серию и пр. | о | - | - | - | - | - | - | - | - | - | |
| Подготовка сырья и материалов | и | о | - | - | - | - | - | - | у | - | |
| Смешение | и | о | - | - | - | - | - | - | у | - | |
| Грануляция | и | - | о | - | - | - | - | - | у | - | |
| Сушка гранулята | и | - | - | о | - | - | - | - | у | - | |
| Опудривание гранулята | и | - | - | - | о | - | - | - | у | - | |
| Калибровка гранулята | и | - | - | - | - | о | - | - | у | - | |
| Прессование | и | - | - | - | - | - | о | - | у | - | |
| Упаковка таблеток | и | - | - | - | - | - | - | о | у | - | |
| Передача полупродукта на следующую операцию | и | у | у | у | у | у | у | у | у | - | |
| Заполнение маршрутных карт | ои | о | о | о | о | о | о | о | - | - | |
| Проставление подписи исполнителя с расшифровкой | ои | о | о | о | о | о | о | о | - | - | |
| Укрепление и замена идентификационных этикеток | о | - | - | - | - | - | - | - | - | - | |
| Передача готовой продукции на склад | о | - | - | - | - | - | - | у | у | - | |
| Очистка оборудования и уборка помещений | о | у | у | у | у | у | у | у | у | у |
Обозначения: о –ответственный, и –информируется, у– участвует, у – может участвовать,
- не участвует
Таблица 5Т
Поставщики и входы процесса
| №№ п/п | Поставщик | Вход |
| Процесс производства таблетированного препарата (основной процесс, или процесс верхнего уровня, или 1-го уровня) | 1. Сменный, суточный, декадный, месячный или квартальный план производства ЛС 2. Заявка на получение сырья и материалов для цеха (участка, площадки и пр.) на 1 серию 3. Технологический регламент 4. Технологические инструкции 5. Полный пакет СОПов | |
| Процесс контроля качества (вспомогательный процесс подтверждения соответствия) | 1. Спецификации на сырье и материалы 2. ФСП 2. Отчеты об аналитическом контроле 3. Уведомления о разрешении использования сырья и материалов в производстве 4. Контрольные и архивные образцы сырья и материалов | |
| Процесс хранения сырья и материалов | 1. Сырье и материалы 2. Документация складского учета: стеллажные карточки, карточки складского учета, накладные и т.д. 3. Сертификаты (НД, паспорта) качества |
Даже одно только внимательное прочтение данного раздела с уяснением и анализом табл. 5Т и 6Т позволяет заинтересованному читателю существенно улучшить свое представление о фармацевтическом технологическом процессе, как с точки зрения его владельца, так и возможного исполнителя, а овладение философией СМК может помочь исполнителю процесса со временем перейти в ранг его владельца с повышением своего статуса.
Таблица 6Т
Выходы и потребители (клиенты) процесса
| №№ п/п | Выход | Потребитель (клиент) |
| 1. Серия таблетированного лекарственного средства определенного наименования 2. Разрешение Уполномоченного лица на выпуск серии лекарственного средства 3. Накладные | Процесс хранения лекарственного средства | |
| 1. Спецификация на лекарственное средство 2. Сертификат качества (аналитический паспорт) на серию, подписанный начальником ОКК 3. Контрольные и архивные образцы серии лекарственного средства | Процесс контроля качества (подтверждения соответствия) | |
| 1. Ежесменная (суточная, декадная, месячная, квартальная) отчетность владельца процесса (начальника цеха, участка и сменного мастера) | Процесс производства таблетированного препарата (основной процесс, или процесс верхнего уровня, или 1-го уровня) |
7.1.4.3. Жизненный цикл продукции, ЖЦП (жизненный цикл лекарственного средства, ЖЦЛС).Понятие ЖЦП появилось в середине 60-х годов XX в. на Западе, а в 70-х – и в бывшем СССР (ГОСТ 24525.0-80 «Управление производственным объединением и промышленным предприятием»). ЖЦП в его современной трактовке описан в разделе 7 «Процессы жизненного цикла продукции» ГОСТ Р ИСО 9001-2001. В соответствии с этой трактовкой, ЖЦП в широком смысле может быть определен как совокупность процессов, осуществляемых от момента выявления потребностей общества в этой продукции до момента их удовлетворения и утилизации продукции. В теории управления рассматриваютследующие основные стадии жизненного цикла продукции, которые графически могут быть изображены следующим образом (рис. 12).
Следует различать: полный жизненный цикл продукции; жизненный цикл продукции в сфере производства; жизненный цикл продукции в сфере потребления.
7.1.4.3.1. Полный ЖЦП. Полный жизненный цикл продукции включает время создания, период производства и время эксплуатации изделий потребителями вплоть до полного износа и утилизации (в сфере обращения ЛС – до момента приема лекарственного средства пациентом). Это понятие используется для планирования этапов маркетинга, дизайна, снабженческо-сбытовой деятельности, формирования производственной инфраструктуры и организации послепродажного прослеживания судьбы произведенной продукции, выбора адекватных форм управления и создания необходимых структурных звеньев. Полный ЖЦП в форме позиционирования составляющих его процессов представлен на рис. 13.

Рис. 12. Стадии жизненного цикла продукции во времени
Примечание:
зарождение - период выхода новой продукции на рынок (началась продажа товара, но прибыль от его производства и реализации еще не получена);
рост - период, когда в отсутствии жесткой конкуренции предприятие пользуется результатом своего лидерства, (замедление роста - появляются первые признаки насыщения рынка и предложение начинает опережать спрос);
зрелость - рынок насыщен и имеются значительные избыточные мощности предприятия. На рынке появилась конкурирующая продукция и приходится уменьшать цену для наращивания или сохранения объема продаж;
спад - снижение объема спроса, предопределяемое сильной конкуренцией или уменьшением потребления продукции;
стабилизация -устойчивое сохранение спроса в результате востребованности продукции и отсутствия активной конкуренции.

Рис.13. Позиционирование процессов внутри жизненного цикла продукции
Обозначения: CALS – компьютерная поддержка процесса поставок
(Computer Aided Logistic Support)
ИАСУ – информационно-аналитическая система управления
АСУП – автоматизированная система управления производством
Первые работы по созданию интегрированных систем, поддерживающих жизненный цикл продукции, были начаты в 80-х годах в оборонном комплексе США. Новая концепция оказалась востребованной как эффективный инструмент совершенствования управления материально-техническим обеспечением Армии США, разбросанной по всему миру. Предполагалось, что реализации этой концепции, получившей обозначение CALS (Computer Aided Logistic Support – компьютерная поддержка процесса поставок), позволит сократить затраты на организацию информационного взаимодействия государственных учреждений с частными фирмами в процессах формализации требований, заказа, поставок и эксплуатации военной техники. Появилась реальная потребность в организации интегрированной информационной системы, обеспечивающей обмен данными между заказчиком, производителями и потребителями этой техники, а также повышение управляемости, сокращение бумажного документооборота и связанных с ним затрат. Доказав свою эффективность, концепция последовательно совершенствовалась, дополнялась и, сохранив существующую аббревиатуру (CALS), получила более широкую трактовку – Continuous Acqusition and Life cycle Support – непрерывные поставки и информационная поддержка жизненного цикла продукции.
Первая часть термина – Continuous Acqusition (непрерывные поставки) означает непрерывность информационного взаимодействия с заказчиком в ходе формализации его потребностей, формирования заказа, процесса поставки и т.д. Вторая часть – Life Cycle Support (поддержка жизненного цикла продукции) – означает системность подхода к информационной поддержке всех процессов жизненного цикла продукции, в том числе процессов эксплуатации, обслуживания, ремонта, утилизации и т.д.
За последние 10 лет в мире был выполнен целый ряд проектов, направленных на апробацию и внедрение принципов CALS в различных отраслях промышленности. Поскольку термин CALS всегда носил военный оттенок, в гражданской сфере более широкое распространение получили термины Product Life Cycle Support (PLCS) или Product Life Management (PLM) – «поддержка жизненного цикла продукции» или «управление жизненным циклом изделия».
Таким образом, идея, связанная только с поддержкой логистических систем, превратилась в глобальную бизнес-стратегию перехода на безбумажную электронную технологию повышения эффективности бизнес-процессов за счет информационной интеграции и совместного использования информации на всех этапах жизненного цикла продукции. В настоящее время в мире действуют более 25 национальных организаций, координирующих вопросы развития CALS-технологий, в том числе в США, Канаде, Японии, Великобритании, Германии, Швеции, Норвегии, Австралии, а также в НАТО.
7.1.4.3.1.1. Полный ЖЦЛС. Полный жизненный цикл ЛС как особого, специфического вида продукции, предназначенного для непосредственного контакта с организмом человека, включает следующие этапы:
- разработку (дизайн);
- экспериментальное исследование (доклинические испытания, GLP, Приказ Минздрава № 267 от 19.06.2003);
- производство ЛС для клинических исследований (как правило, в лабораторных условиях по нестандартным методикам, ГОСТ Р 52249-2004, приложение 13);
- клинические испытания (GCP*, Приказ Минздрава РФ № 266 от 19.06.2003);
- промышленное производство (GMP, ГОСТ Р 52249-2004);
- складское хранение (проект GSP – Good Storage Practice);
- оптовая торговля, или дистрибьюция (GDP, ОСТ 91500.05.00055-2002);
- розничная продажа через аптечные учреждения (GPP, ОСТ 91500.05.0007-2003);
- прием ЛС больным;
- V фаза клинических испытаний (пострегистрационный надзор, может продолжаться 20 лет и более).
Следует отметить, что ЖЦЛС, без учета V фазы клинических испытаний, занимает период от 5 до 15 лет и может оцениваться в сумму до 1 млрд. долларов и более. Наиболее длительными этапами являются дизайн ЛС, когда разработчики исследуют зачастую десятки тысяч химических структур биологически активных веществ (БАВ) на предмет их возможного воздействия на патологический процесс (болезнь) организма человека, а также клинические испытания, во время которых изучаются вопросы безопасности и эффективности отобранных БАВ уже в качестве потенциальных ЛС.
Созданное в результате ЛС представляет собой сложную физико-химическую систему, в которой действующее(ие) лекарственное(ые) вещество(а) заключено(ы) в строго определенную лекарственную форму, признанную разработчиком оптимальной для максимального проявления терапевтического (лечебного, фармакологического) действия при минимуме побочных эффектов.
Разработка ЛС осуществляется командой специалистов, где выбором и выяснением механизма лечебного действия лекарственного вещества занимаются фармакологи, а созданием лекарственной формы этого вещества – провизоры (фармацевты) – технологи.
Одно и тоже лекарственное вещество (вещества) может иметь несколько лекарственных форм (таблеток, капсул, инъекционных, суппозиториев и др.), применение которых в каждом конкретном случае определяется врачом по показаниям состояния организма больного.
Необходимо подчеркнуть, что ЛС в соответствии с Федеральным законом «О лекарственных средствах» от 22.06.98 N 86-ФЗ требует обязательной государственной регистрации в Росздравнадзоре. Незарегистрированное ЛС таковым не является и не может быть использовано для целей терапии. Аналогичная процедура существует и в других странах: в эпоху глобализации и гармонизации легитимизация сферы обращения ЛС везде примерно одинакова.
При приеме человеком система «лекарственное средство» взаимодействует с системой «организм человека», в результате чего возникает новая, более сложная система «организм-лекарственное средство», где и реализуется профилактическое, лечебно-профилактическое ли лечебное действие ЛС. Этот момент ЖЦЛС является кульминационным: именно ради него разрабатывается, исследуется, производится, хранится и распространяется ЛС, тратятся сотни миллионов долларов, задействуются сотни и тысячи ученых, специалистов, менеджеров, производственных работников, врачей, провизоров, фармацевтов, людей других профессий.
Если этап дизайна ЛС оказывается успешным, а его производство – высококачественным, мир получает эффективный препарат, который стремительно врывается на фармацевтический рынок, завоевывая признание врачей и больных. Его повсеместное назначение по объективным показаниям приводит к росту потребления и спроса, иногда лавинообразному, за которым следует рост производства. Многомиллионные затраты быстро окупаются, начинает расти норма прибыли. Если препарат эффективен, а побочные явления при его приеме минимальны, он может обращаться на рынке многие годы, принося больным выздоровление, а разработчикам, производителям и дистрибьюторам – весомую прибыль. Можно привести множество примеров того, как высокоэффективные ЛС завоевывали рынок, оставаясь на нем десятилетиями. Это, прежде всего аспирин, препараты антибиотиков, инсулины продленного действия, транквилизаторы типа седуксена, нестероидные противовоспалительные средства ибупрофенового ряда, сердечно-сосудистые препараты нового поколения типа статинов, оборот которых ежегодно достигает миллиардов долларов, и многие, многие другие.
Следует подчеркнуть, что все эти успехи достигнуты теми компаниями, где уже долгие годы эффективно функционирует и совершенствуется СМК.
Официальным первоисточником информации о ЖЦЛС в нашей стране является Государственный информационный стандарт лекарственного средства – ОСТ ГИСЛС № 91500.05.0002-2001, введенный приказом Минздрава РФ от 26 марта 2001 г. № 88.
7.1.4.3.1.2. Жизненный цикл ЛС в сфере производства.В настоящем учебнике, как уже указывалось в разделе 1, рассматривается СМК исключительно на этапе ЖЦЛС, связанном с его промышленным производством. ЖЦЛС в сфере производства весьма короток: выпуск одной серии ЛС занимает обычно две-три рабочие смены, т.е. в среднем от 12 до18 часов плюс период карантина. ЛС может непрерывно производится много лет подряд без перерыва на одном или нескольких фармацевтических предприятиях в одной или нескольких странах. Так, например, уже упомянутый аспирин (ацетилсалициловая кислота) производится непрерывно германским фармацевтическим концерном Байер (бессрочным владельцем брэнда «аспирин») свыше 100 лет, кроме того, это лекарственное средство выпускается еще более чем в 50 странах сотнями других производителей. И везде аспирин должен строго соответствовать требованиям спецификаций, для чего на производящих его предприятиях существует (или должна существовать) СМК. ЖЦЛС на этапе производства представляет собой ряд последовательных организационных и технологических стадий (рис. 14).

- - организационные стадии
- - технологические стадии
Рис.14. ЖЦЛС на этапе фармацевтического производства
ЖЦЛС на этапе фармацевтического производства может быть также представлен в процессном формате «входы-выходы» (рис. 15).

Рис. 15. Жизненный цикл ЛС в процессном формате «входы-выходы»
Более детально ЖЦЛС на этапе производства в форме таблетированного препарата и инъекционного препарата как пример представлен выше на рис. 10 и 11.
Существо производственного этапа ЖЦЛС заключается в том, чтобы полностью перенести все свойства и особенности лекарственного средства, выявленные и достигнутые на стадии разработки (дизайна) и клинических испытаний, на его серийный (промышленный) выпуск без каких-либо искажений или отклонений, т.е. «точь в точь». С этой целью разработчики создают технологический регламент (технологические инструкции) и спецификации, которым производитель должен неукоснительно следовать. Целью СМК на фармацевтическом предприятии является обеспечение гарантий того, что производимое ЛС будет всегда соответствовать требованиям разработчика, изложенным в технологическом регламенте (технологических инструкциях) и спецификациях на это ЛС как составных элементов его регистрационного досье. Эта цель достигается, как уже отмечалось выше, применением стандарта GMP.
7.1.5. Документация. Для управления процессами в рамках СМК необходимо наличие на предприятии–производителе лекарственных средств полноценного комплекта соответствующей документации.
В пункте 4.2.1 ГОСТ Р ИСО 9001-2001 «Системы менеджмента качества. Требования» сказано, что «Документация системы менеджмента качества должна включать:
а) документально оформленные заявления о политике и целях в области качества;
б) руководство по качеству;
в) документированные процедуры, требуемые настоящим стандартом;
г) документы, необходимые организации для обеспечения эффективного планирования, осуществления процессов и управления ими;
д) записи, требуемые настоящим стандартом (4.2.4)».
При этом в ГОСТ Р ИСО 9001-2001 определяется, что собой представляют документы, оговоренные в пунктах а), б), в) и д), но ничего не говориться о документах, оговоренных в пункте г). Поэтому в известной литературе по системам менеджмента качества, как правило, исключаются из рассмотрения документы, оговоренные в пункте г), что существенно затрудняет корректное определение состава и содержания всей совокупности документов системы менеджмента качества. В настоящем учебнике предпринята попытка восполнить этот очевидный пробел.
Основной задачей документации СМК предприятия – производителя лекарственных средств является структуризация и регламентация всей его деятельности, влияющей на качество лекарственных средств. Указанное означает, что используемая на предприятии документация должна определять:
- требования к процессам, влияющим на качество лекарственных средств;
- ответственность персонала за управление процессами, влияющими на качество лекарственных средств;
- порядок управления процессами, влияющими на качество лекарственных средств;
- порядок регистрации результатов управления процессами, влияющими на качество лекарственных средств;
- порядок информирования о выполненных действиях.
Исходя из изложенного, документы системы менеджмента качества представляется возможным объединить в три большие группы. Первую составляют предписывающие документы, которые определяют предписания и инструкции по выполнению определенных действий; вторую – фиксирующие документы, которые служат для подтверждения выполненных в соответствии с предписаниями действий; а третью – информационные документы, с помощью которых осуществляется информирование о выполнении предписанных действий (рис. 16).

Рис. 16. Классификация документов системы менеджмента качества
Здесь термин «предписание» понимается в самом широком смысле, а именно: официальное распоряжение, документ, содержащий такое распоряжение; указание, предложение что-либо делать; принятое, узаконенное положение и т.п. Предписывающие документы включают документы внешнего и внутреннего происхождения. К предписывающим документам внешнего происхождения (нормативным документам) относятся Законы Российской Федерации, постановления Правительства Российской Федерации, государственные стандарты, Государственная Фармакопея, Промышленные регламенты, Фармакопейные статьи, Фармакопейные статьи предприятия и другие документы, выпущенные или утвержденные (согласованные) внешними органами и касающиеся различных вопросов создания и совершенствования систем менеджмента качества.
Фармакопейная статья предприятия (ФСП) представляет собой стандарт качества лекарственного средства под торговым названием (брэндом), содержащий перечень показателей и методов контроля качества лекарственного средства производства конкретного предприятия, учитывающий конкретную технологию данного предприятия, и прошедший экспертизу и регистрацию в установленном порядке. Впервые понятие и определение фармакопейной статьи предприятия введено ОСТ 91500.05.001-00 в 2000 году. Фармакопейная статья предприятия является его интеллектуальной собственностью.
Дата добавления: 2016-09-20; просмотров: 1073;
