Сахарный диабет 2 типа
В настоящее время полагают, что примерно 80% кошек с диабетом страдает от заболевания, подобного диабету 2 типа, хотя подробных исследований, которые подтвердили бы это допущение, не проводилось. Тем не менее, большинство эндокринологов согласилось бы, что диабет, подобный 2 типу, является наиболее распространенной формой у кошек. Как и у людей, у кошек диабет 2 типа представляет собой неоднородное заболевание, как полагают, обусловленное нарушением действия инсулина в печени, мышцах и жировой ткани (резистентностью к инсулину) в сочетании с недостаточностью β-клеток. Полагают, что в развитии обоих дефектов играют роль как внешние, так и генетические факторы (см. рис. 7-2).
Генетические факторы. Генетические факторы начали исследовать лишь недавно (Forcada et al, 2010). Однако вероятнее всего, что диабет у кошек, как и у людей, представляет собой полигенное заболевание, и роль в повышении риска играют многие гены. Наиболее убедительные доказательства генетических основ получены в исследованиях на бурманских кошках. В племенных линиях из Австралии, Новой Зеландии и Великобритании частота сахарного диабета у бурманских кошек была примерно в 4 раза выше, чем у домашних кошек. В некоторых семействах бурманских кошек более 10% потомства страдало от диабета (Rand et al, 1997; Wade et al, 1999; McCann et al, 2007; Lederer et al, 2009).
Ожирение, пол и другие факторы риска. Один из основных факторов риска развития диабета у кошек – ожирение. Прочие факторы риска включают пол (предрасположенность котов), недостаточную физическую активность и содержание исключительно в доме, пожилой возраст и введение глюкокортикоидов и прогестагенов (Panciera et al, 1990; Crenshaw and Peterson, 1996; Scarlet and Donoghue, 1998; McCann et al, 2007; Prahl et al, 2007; Slingerland et al, 2009). Показано, что риск развития сахарного диабета у кошек с ожирением в 3,9 раз выше, чем у кошек с оптимальным весом (Scarlett and Donoghue, 1998). Экспериментальные диетологические исследования на здоровых кошках показали, что средний набор веса 1,9 кг снижает чувствительность к инсулину более чем на 50% (Appleton et al, 2001). Сходные результаты сообщаются в другом исследовании, показавшем, что повышение веса на каждый килограмм приводит к снижению чувствительности к инсулину примерно на 30% (Hoenig et al, 2007). Чувствительность к инсулину имеет значительные индивидуальные различия; предполагалось, что кошки с низкой чувствительностью к инсулину от природы входят в группу риска непереносимости при наборе веса. У котов отмечена тенденция к меньшей чувствительности к инсулину до начала исследования, и они набрали больше веса, чем кошки, что может частично объяснить повышенный риск развития сахарного диабета у котов (Appleton et al, 2001). Механизмы резистентности к инсулину на клеточном уровне и зависимость между разными обнаруженными изменениями у кошек пока не поняты. Большинство исследований, проведенных до настоящего времени, посвящено транспортерам глюкозы (GLUT), генам, участвующим в инсулиновой сигнализации в чувствительных к инсулину тканях, а также секреции адипоцитокинов жировой тканью. У кошек, у которых развилось ожирение, экспрессия чувствительного к инсулину GLUT-4 в мышцах и жире была значительно ниже, чем у худых кошек, в то время как экспрессия GLUT-1, нечувствительного к инсулину, осталась неизменной (Brennan et al, 2004). Экспрессия нескольких генов, участвующих в инсулиновой сигнализации в печени и скелетных мышцах, у кошек с ожирением была значительно ниже, чем у худых кошек, что сходно с резистентностью к инсулину у людей (Mori et al, 2009a).
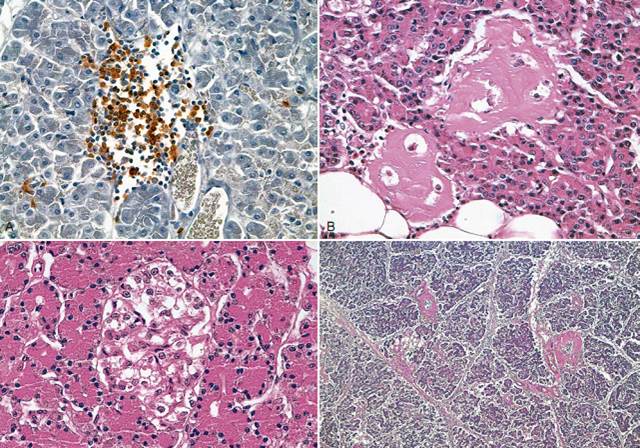
РИС. 7-3. Гистологический препарат поджелудочной железы. A, сильная инфильтрация островка поджелудочной железы Т-лимфоцитами у 18-летней домашней короткошерстной (ДКШ) кошки с сахарным диабетом. Это редкая находка, так как обычно у кошек с диабетом лимфоциты в островках не обнаруживаются или присутствуют лишь в небольшом количестве. Иммуногистохимическое окрашивание на кластер дифференциации 3 (CD3), гематоксилин и эозин (Г/Э), контрастное окрашивание (x 40). B, амилоидоз островка у 16-летней кастрированной ДКШ кошки с сахарным диабетом (Г/Э, x 40). C, вакуольная дегенерация островка у 9-летнего кастрированного ДКШ кота с диабетом (Г/Э, x 40). D, фиброз экзокринной части поджелудочной железы у 8-летней сиамской кошки с сахарным диабетом (Г/Э, x 40). (Источник: Zini E, et al.: Histological investigation of endocrine and exocrine pancreas in cats with diabetes mellitus, J Vet Intern Med 26 (резюме):1519, 2012.)
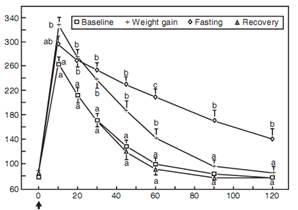
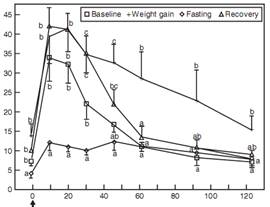
Адипокины и воспалительные цитокины. В настоящее время известно, что жировая ткань кошек, как и людей, является активным и сложным эндокринным органом. Показано, что концентрация адипонектина, образующегося почти исключительно жировой тканью, у кошек снижается при ожирении и сахарном диабете (Bromel et al, 2004; Hoenig et al, 2007). Адипонектин принадлежит к большой группе молекул, синтезирующихся в жировой ткани и объединяемых под общим названием «адипокины». Адипонектин повышает чувствительность к инсулину и обладает противовоспалительными свойствами; таким образом, снижение способствует резистентности к инсулину и воспалению. Лептин, адипокин-«прототип», участвует в подавлении аппетита и затратах энергии, а также играет роль в модулировании чувствительности к инсулину (Radin et al, 2009). Обнаружено, что кошки с ожирением резистентны к лептину (т. е. концентрация лептина, не вызывающая соответствующей физилогической реакции, у них намного выше, чем у худых кошек) (Hoenig, 2012). Как описано ранее, известно, что у людей жировая ткань секретирует ряд воспалительных цитокинов, а ожирение в настоящее время считается состоянием хронического воспаления низкой степени. ФНО-α – первый фактор жировой ткани, предположительно связывающий ожирение и резистентность к инсулину при диабете 2 типа у людей; этот цитокин сильно подавляет инсулиновую сигнализацию. В настоящее время известно, что в воспалительном процессе у людей также участвуют различные дополнительные цитокины и хемокины (Kanaya and Vaisse, 2011). Возможно, жировая ткань кошек ведет себя сходным образом, так как концентрация ФНО-α (в жировой ткани) у кошек с ожирением была значительно выше, чем у худых (Hoenig et al, 2006). Для подкрепления этих данных необходимы дальнейшие исследования, в особенности, спонтанно развившегося диабета. Заинтересованные читатели могут обратиться к обзорам Radin, et al, (2009) и German, et al, (2010) за более подробной информацией об ожирении, адипокинах и воспалении. В повседневной практике важно знать, что резистентность к инсулину, развивающаяся при наборе веса, обратима после снижения веса. Когда здоровых кошек кормили неограниченно, набор веса сопровождался значительным повышением концентраций глюкозы и инсулина при внутривенном тесте толерантности к глюкозе (ТТГ) по сравнению с исходными значениями, а общая секреция инсулина была значительно выше. Через несколько недель после снижения веса за счет ограничения калорийности рациона результаты ТТГ вернулись примерно к исходным значениям (Biourge et al, 1997; рис. 7-4). Исследование подчеркивает важность поддержания веса на протяжении жизни, особенно у кошек с диабетом.
А В
| Глюкоза (мг/дл) |
Инъекция Время, мин. глюкозы | Инсулин (мкЕд./мл) |
Инъекция Время, мин. глюкозы |
РИС. 7-4.Средние концентрации глюкозы (A) и инсулина (B) (± стандартная ошибка среднего [СОС]) у 12 кошек после внутривенного (в/в) введения 0,5 г глюкозы на кг массы тела при зачислении в исследование (начало), после 9 ± 2 мес. набора веса, после добровольного снижения веса в течение 5-6 недель (потеря веса) и через 5 недель после завершения голодания (восстановление), a-c, пункты с разными буквами значительно различаются (р<0,05) между периодами. Обратите внимание на сниженную толерантность к глюкозе несмотря на повышение секреции инсулина при наборе веса и улучшение толерантности к глюкозе, а также усиленную реакцию секреции инсулина при потере веса. (Источник: Biourge V, et ah Effect of weight gain and subsequent weight loss on glucose tolerance and insulin response in healthy cats, J Vet Intern Med 11:86, 1997).
Дисфункция бета-клеток, амилоид и глюкозотоксичность. Важно отметить, что, хотя ожирение индуцирует резистентность к инсулину, не у всех кошек с ожирением развивается сахарный диабет. Здоровые β-клетки адаптируются к ожирению и резистентности к инсулину, усиливая секрецию инсулина для поддержания нормальной толерантности к глюкозе (см. также рис. 7-2). Кроме того, организм кошки, по-видимому, способен снижать выработку глюкозы печенью в случае периферической резистентности к инсулину (Hoenig, 2012). Для развития диабета необходима дисфункция β-клеток, ведущая к нарушению толерантности к глюкозе и, в конечном итоге, к диабету 2 типа. К сожалению, данных о функции β-клеток и секреции инсулина у кошек со спонтанно развившемся диабетом почти нет. Большинство исследований проводилось на здоровых кошках, у которых вызывали ожирение за короткий период неограниченного кормления. В одном исследовании у кошек вызывали диабет путем удаления поджелудочной железы и введения препаратов-антагонистов инсулина (Hoenig et al, 2000b). Из этого исследования можно сделать заключение, что на ранней стадии диабета первая фаза высвобождения инсулина наступает с задержкой и слабее выражена, в то время как во вторую фазу секреция инсулина более явна; на этой стадии базальная концентрация глюкозы все еще нормальна. Со временем первая фаза секреции инсулина почти полностью исчезает, секреция становится нерегулярной и общее количество инсулина во время 2-часового ТТГ значительно снижается. В это время базальная концентрация глюкозы повышается (т. е. присутствует явный диабет). В качестве напоминания: у здоровых худых кошек секреция инсулина при стимуляции глюкозой во время ТТГ двухфазная (Hoenig et al, 2000b; Hoenig, 2012).
Большой вопрос: «что в точности вызывает недостаточность β-клеток при спонтанном развитии диабета?» остается без ответа до сих пор. Согласно одной уже давно известной гипотезе, разрушение β-клеток обусловлено отложениями амилоида. Амилоид островков образуется из гормона, называемого ОАПП и известного также как амилин. ОАПП – нормальный продукт β-клеток, запасающийся вместе с инсулином в секреторных пузырьках и секретирующийся вместе с ним в кровь. Концентрация ОАПП повышается при состояниях, связанных с резистентностью к инсулину (например, у кошек с ожирением) (Henson et al 2011). Только кошки, люди и нечеловекообразные приматы имеют амилоидогенную аминокислотную структуру ОАПП, потенциально способную откладываться в виде амилоида в островках поджелудочной железы (OBrien, 2002; Hull et al 2004). Отложения амилоида обнаружены у многих кошек с диабетом; однако часто они обнаруживаются и у здоровых кошек. В недавнем исследовании отложения амилоида обнаружены у 56% кошек-диабетиков и у 42% контрольных кошек, подобранных по возрасту, полу и массе тела, их количество также было сравнимо (Zini et al, 2012; см. рис. 7-3, B). У людей ситуация сходна, так как амилоидные отложения в островках поджелудочной железы присутствуют как у многих больных диабетом 2 типа, так и у значительного процента здоровых (Alshali and Gerich, 2010).
Остаются открытыми следующие вопросы: «почему не у всех индивидов с амилоидогенной структурой амилина образуются амилоидные отложения?» и «является ли амилоид причиной или следствием заболевания?» Показано, что нарушение свертки белковых молекул и/или перемещения амилина внутри β-клеток ведет к формированию так называемых токсичных олигомеров. Эти внутриклеточные молекулы индуцируют цитотоксичность, могут привести к снижению функции β-клеток и их апоптозу. Внеклеточные отложения амилоида, по-видимому, менее токсичны и представляют собой конечный результат неправильной свертки (Costes et al, 2013). Таким образом, нарушение функции β-клеток может присутствовать до появления видимых отложений амилоида. Мнения разных научных групп о значимости ОАПП/амилоида в патогенезе недостаточности β-клеток различаются (особенно в медицине). Вероятно, что неправильная свертка молекул отражает другой дефект β-клеток и не является первопричиной их дисфункции. Тем не менее, эти отклонения способны ускорить дальнейшее повреждение. Дополнительный фактор, отрицательно сказывающийся на функции и выживании β-клеток – высокая концентрация глюкозы, то есть явление, известное как глюкозотоксичность. Почти нет сомнений, что глюкозотоксичность – вторичный эффект, так как гипергликемия становится очевидной только после того, как начинает развиваться недостаточность β-клеток. Однако контроль гликемии с помощью инсулиновой терапии обращает некоторые из отрицательных эффектов, и исчезновение глюкозотоксичности – важный механизм, объясняющий ремиссию диабета. Липотоксичность – термин, обозначающий повреждающее действие высоких концентраций свободных жирных кислот; однако возможно, что у кошек значимость липотоксичности ниже, чем глюкозотоксичности (Zini et al, 2009a). Подробности обсуждаются в разделе о ремиссии диабета. У людей с диабетом 2 типа описаны воспалительные изменения островков, потенциально способствующие апоптозу β-клеток (Robertson, 2009; Donath and Shoelson 2011). Как упоминалось в начале этого раздела, в островках у кошек с диабетом обнаружено больше лимфоцитов по сравнению с соответствующей контрольной популяцией. По мнению авторов, это могло способствовать гибели β-клеток (Zini et al, 2012). Очевидно, что для определения роли воспаления островков необходимо больше исследований.
Прочие специфические типы диабета (вторичный сахарный диабет)
Сахарный диабет у кошек может развиться как последствие другого заболевания или введения диабетогенных лекарств, таких как глюкокортикоиды и прогестины. У людей в эту категорию входят различные нарушения (в особенности, генетические), до настоящего времени неизвестные у кошек. Известно, что некоторые из подкатегорий, например диабет, связанный с заболеваниями поджелудочной железы или другими эндокринными нарушениями, также встречаются у кошек. Эти заболевания могут составлять у них примерно до 20% случаев. Относительно распространен диабет, индуцированный глюкокортикоидами или прогестинами (см. также «Сопутствующие заболевания, вызывающие резистентность к инсулину, и лекарственно-индуцированный диабет»). Взаимоотношения между эндокринной и экзокринной частями поджелудочной железы сложны. Например, ткань ацинусов тесно соприкасается с островками без окружающей капсулы или базальной мембраны, а островково-ацинарная портальная система обеспечивает сообщение между двумя частями (Chen et al, 2011). Таким образом, важно понимать, что патология одной части скажется и на второй. За последние годы панкреатиту уделялось повышенное внимание, и в настоящее время известно, что это относительно распространенное заболевание у кошек. Однако причинно-следственную связь между панкреатитом и диабетом у кошек сложно установить, и о ней известно очень мало. В предыдущих исследованиях гистологческие отклонения, соответствующие панкреатиту, были обнаружены у 22 и 51% кошек с диабетом. Обнаруженные изменения включали нейтрофильную инфильтрацию и некроз как следствие острого панкреатита, а также диффузную лимфоцитарную и лимфоцитарно-плазмоцитарную инфильтрацию, считающуюся характерной для хронического панкреатита (Kraus etal, 1997; Goossens et al, 1998). Однако недавние гистологические исследования также показали высокую распространенность панкреатита у кошек, не страдающих диабетом. De Cock, et al., (2007) провели гистологическое исследование поджелудочной железы 115 кошек, подвергнутых эутаназии по разным причинам; 41 из них были клинически здоровы. Общая распространенность панкреатита составила 67%, признаки хронического панкреатита обнаружены в 50,4%, а острого – в 6,1% случаев, и приблизительно в 10% случаев присутствовали признаки как острого, так и хронического панкреатита. Недавно мы исследовали ткань поджелудочной железы 37 кошек с диабетом в сравнении с тканью 20 соответствующих контрольных кошек по гистологическим критериям, описанным De Cock, et al. Результаты у контрольных кошек были сходны с описанными в исследовании этих авторов; интересно, что распространенность патологических изменений поджелудочной железы у кошек-диабетиков была настолько же высокой, как у контрольных здоровых кошек. Общая распространенность панкреатита у кошек с диабетом составила 57%, а у контрольных кошек – 60%. У кошек с диабетом отмечена тенденция к более тяжелым повреждениям и большей распространенности острого панкреатита; однако различие не было значимым (Zini et al, 2012). De Cock, et al., (2007) полагали, что поджелудочная железа очень чувствительна к лекарствам, стрессу, метаболическим нарушениям или ишемии, связанной с разнообразными заболеваниями. По имеющимся на данный момент сведениям и впечатлениям автора, панкреатит не относится к распространенным причинам сахарного диабета. Хотя в принципе тяжелый панкреатит с обширным разрушением тканей может привести к повреждению островков поджелудочной железы и гибели β-клеток, по-видимому, это редкое явление. Тем не менее, панкреатит – распространенное сопутствующее заболевание и очень вероятно, что он развивается на фоне диабета. У значительного процента кошек он, по-видимому, развивается как клинически незначимый второстепенный процесс, однако у других сопровождается клиническими симптомами и временами очень осложняет регуляцию диабетического состояния. Панкреатит также может играть роль в развитии диабетического кетоацидоза (ДКА) (Goossens et al, 1998; Armstrong and Williams, 2012). Иногда сахарный диабет выявляется в сочетании с аденокарциномой поджелудочной железы; в медицине вопрос о том, обусловлен ли диабет прямыми эффектами опухоли или диабетогенными веществами, вырабатываемыми раковыми клетками, остается спорным (Chen et al, 2011).
Среди эндокринных нарушений, перечисленных под заголовком «Прочие специфические типы диабета» в рамке 7-1, у кошек наиболее значимы гиперсоматотропизм (акромегалия) и гиперадренокортицизм. Почти у всех кошек с гиперсоматотропизмом и примерно у 80% кошек с гиперадренокортицизмом развивается диабет, часто сложно поддающийся контролю из-за тяжелой резистентности к инсулину. В то время как гиперадренокортицизм редок, гиперсоматотропизм встречается у 10-15% кошек-диабетиков. Более подробные сведения см. в гл. 2 и 11. Гипертиреоз и гиперальдостерония у кошек редко связаны с клиническим диабетом, а феохромоцитома крайне редка.
Подводя итог, сахарный диабет у кошек – неоднородное заболевание, вызываемое большим количеством разных факторов; точные этиопатогенетические механизмы в данный момент неизвестны. К основным гистологическим изменениям островков относятся снижение количества β-клеток при сохранении других типов эндокринных клеток; отложения амилоида и вакуольная дегенерация; у некоторых кошек обнаруживается лимфоцитарная инфильтрация (см. рис. 7-3, А-D). В экзокринной части поджелудочной железы может присутствовать некроз и фиброз, а также нейтрофильная или лимфоцитарная инфильтрация, отражающая острый или хронический панкреатит.
Дата добавления: 2016-09-20; просмотров: 1273;
