Участок: точка эквивалентности. В точке эквивалентности (добавлено 100,0 мл 0,1 н
В точке эквивалентности (добавлено 100,0 мл 0,1 н. HCl) в растворе присутствует только соль NH4Cl, образованная слабым основанием и сильной кислотой, которая подвергается гидролизу по катиону:
NH4+ + H2O  NH4OH + H+.
NH4OH + H+.
Для гидролизующейся соли рН рассчитывается через ее константу гидролиза (Кгидр): 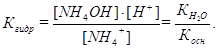
Так как [NH4OH] = [Н+], а при низкой степени гидролиза [NH4+] ≈ СМ(соли), поэтому: 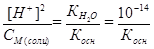 , откуда рН = 7 - ½ рКосн - ½lgСМ(соли).
, откуда рН = 7 - ½ рКосн - ½lgСМ(соли).
4 участок: после точки эквивалентности.Добавлен избыток раствора HCl, который присутствует в растворе вместе с образовавшейся при реакции солью NH4Cl. Гидролиз соли подавлен избыточным количеством катионов водорода, наличие которых и определяет рН раствора на этом участке. После точки эквивалентности расчет рН ведется, как и в случае титрования сильного основания сильной кислотой (см. лекцию 9):
pH = -lg[H+] = -lg С΄M(HCl); 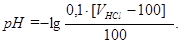
Результаты вычислений значений рН в ходе титрования слабого основания NH4OH сильной кислотой приведены в таблице:
| Добавлено 0,1 н. HCl, мл | 0,0 | 50,0 | 90,0 | 99,0 | 99,9 | 100,0 | 100,1 | 101,0 | 110,0 | 200,0 |
| рН | 11,13 | 9,25 | 8,30 | 7,25 | 6,25 | 5,13 | ||||
| Характерные точки | Начало скачка | Точка экв. | Конец скачка |
При титровании слабого основания сильной кислотой скачок на кривой титрования (рис. 1) и точка эквивалентности лежат в кислой области значений рН. Величина скачка на кривой титрования гидроксида аммония сильной кислотой (от 6,25 до 4) значительно меньше скачка на кривой титрования сильного основания сильной кислотой. В качестве индикатора можно использовать метиловый оранжевый, метиловый красный. Применять фенолфталеин нельзя.
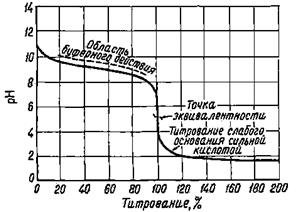
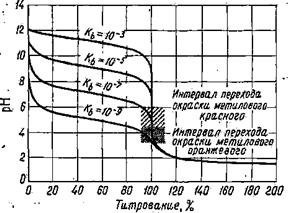
Рис. 1. Кривая титрования 0,1 н. раствора Рис. 2. Зависимость величины скачка на NH4OH 0,1 н. раствором HCl кривой титрования слабого основания
сильной кислотой от константы
диссоциации основания
Величина скачка, как и в случае титрования слабой кислоты сильным основанием, уменьшается с уменьшением концентрации слабого основания, с возрастанием температуры, с уменьшением константы диссоциации слабого основания. Влияние константы диссоциации основания на величину скачка рН на кривой титрования показано на рис. 2. Если Kосн ≤ 10-7, скачок рН на кривой титрования исчезает, а в точке эквивалентности наблюдается только перегиб. Таким образом, прямое титрование слабого основания сильной кислотой и определение точки эквивалентности при помощи индикатора, как и в случае титрования слабой кислоты, возможны только при условии Kосн·СМ(осн) ≥ 10-8.
Контрольные вопросы
1. Приведите формулу расчета рН слабого основания.
2. По какой формуле рассчитывают рН титруемого раствора слабого основания сильной кислотой до точки эквивалентности? Какая система при этом образуется?
3. Как рассчитывают рН в точке эквивалентности при титровании слабого основания? Совпадает ли рассчитанное значение с точкой нейтральности?
4. Как рассчитывают рН после точки эквивалентности при титровании слабого основания?
5. Какие факторы влияют на величину скачка на кривой титрования при титровании слабого основания сильной кислотой?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 140 – 143.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.106 - 108.
С.Б. Денисова, О.И. Михайленко
Дата добавления: 2016-09-20; просмотров: 4083;
