Лекция 10. Кривая титрования слабой кислоты сильным основанием
Ключевые слова: кривая титрования слабой кислоты сильным основанием.
При расчете кривой титрования слабой кислоты щелочью следует учитывать тот факт, что до точки эквивалентности в растворе присутствует буферная смесь, состоящая из неоттитрованной слабой кислоты и ее соли, образованной за счет взаимодействия слабой кислоты со щелочью. В точке эквивалентности в растворе присутствует соль, образованная слабой кислотой и сильным основанием, она подвергается гидролизу по аниону, и среда становится щелочной. За точкой эквивалентности в растворе, как и в случае титрования сильной кислоты, будет находиться в избытке щелочь, и ее содержание в растворе будет определять рН.
Например, построим кривую титрования 100,0 мл 0,1 н. CH3COOH
0,1 н. раствором NaOH.
1 участок: до начала титрования. В первоначальный момент (без добавления NaOH) в растворе присутствует слабая кислота, которая обратимо диссоциирует:
CH3COOH  CH3COO- + H+.
CH3COO- + H+.
рН исходного раствора слабой кислоты рассчитывают, используя ее константу диссоциации:
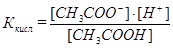 .
.
В растворе на каждый образующийся катион водорода приходится один анион кислоты: [H+] = [СН3СОО–].
Если степень диссоциации кислоты <5% и выполняется условие
Ккисл/СМ(кисл) < 10-2, то можно принять, что [СН3СООН] ≈ СМ(кисл), тогда
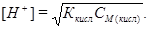
Расчет рН проводят по формуле
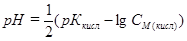 .
.
Для 0,1 н. CH3COOH рН = ½(4,76 – lg0,1) = 2,88.
2 участок: от начала титрования до точки эквивалентности.Добавлено некоторое количество NaOH (VNaOH < 100 мл). В растворе присутствуют недотитрованная слабая кислота СН3СООН и ее соль CH3COONa, полученная в результате протекания реакции:
CH3COOH + NaOH → CH3COONa + H2O.
CH3COONa (соль) является сильным электролитом, полностью диссоциирующим на ионы, следовательно, [СН3СОО–] ≈ СМ(соли).
Диссоциация слабой кислоты в присутствии одноименного иона (СН3СОО–) подавлена, поэтому [СН3СООН] ≈ СМ(кисл).
Таким образом, в растворе до точки эквивалентности присутствуют слабая кислота и соль, образованная этой кислотой и сильным основанием – кислотная буферная смесь. Концентрацию H+ находят из выражения для константы диссоциации слабой кислоты, используя допущенные приближения:
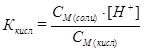 , отсюда
, отсюда 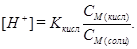
Поскольку исходные концентрации кислоты и щелочи одинаковые, отношение молярных концентраций оставшейся кислоты и образовавшейся соли в растворе определяется соотношением их объемов:
СМ(кисл)/СМ(соли) = [100 - VNаОН]/(VNаОН).
Поэтому до точки эквивалентности расчет рН ведут по формуле для кислотной буферной смеси:
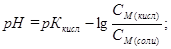
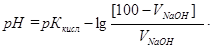
Дата добавления: 2016-09-20; просмотров: 1452;
