Участок: после точки эквивалентности. Добавлено избыточное количество раствора NaOH: VNаОН >100 мл
Добавлено избыточное количество раствора NaOH: VNаОН >100 мл. В колбе для титрования находятся продукты реакции и избыток рабочего раствора NaOH; рН раствора определяется концентрацией избыточного раствора щелочи. Сильное основание диссоциирует полностью на ионы:
NaOH → Na+ + OH-.
При вычислении рН раствора сильных оснований концентрацию ионов ОН– можно приравнять к общей концентрации основания, которую в общем случае можно рассчитать по формуле
[OH-] = С΄M(NаОН) = [NNаОН·VNаОН - NHCl·VHCl]/ (VHCl + VNаОН).
После подстановки значений получаем упрощенную формулу:
[OH-] = С΄M(NаОН) = 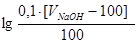 ; pOH = -lg[OH-] = - lg С΄M(NаОН);
; pOH = -lg[OH-] = - lg С΄M(NаОН);
pH = 14 - pOH; 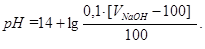
Рассчитываем рН раствора, если добавлено 100,1, 101, 110, 150 и 200 мл рабочего раствора NaOH.
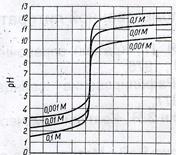
Рассчитанные значения рН при титровании 100мл 0,1 н. раствора НС1 0,1 н. раствором NaOH приведены в таблице и на кривой титрования (рис.1).
| Добавлено 0,1 н. NaOH, мл | 99,9 | 100,1 | |||||||||
| рН | 1,3 | 12,7 | |||||||||
| Характерные точки | Начало скачка | Точка экв. | Конец скачка |
При прибавлении почти всей (99,9 мл) щелочи рН изменяется всего на 3 единицы (от 1 до 4). Переход от 0,1 мл избытка кислоты к 0,1 мл избытка щелочи (от 99,9 мл до 100,1 мл прибавленного NаОН) ведет к изменению рН на 6 единиц (от 4 до 10). Таким образом, вблизи точки эквивалентности происходит резкое изменение рН раствора, на кривой титрования сильной кислоты раствором щелочи присутствует скачок рН от 4 до 10 единиц.
Величина скачка на кривой титрования кислоты основанием зависит от многих факторов. Во-первых, от силы кислоты и основания: чем слабее кислоты и основания, тем меньше скачок. Поэтому в качестве рабочих растворов в методе нейтрализации используют только сильные кислоты или сильные основания. Во-вторых, скачок зависит от концентраций растворов: с уменьшением концентрации уменьшается скачок. Например, при титровании растворов с концентрациями N = 1 н. скачок рН лежит в интервале от 3 до 11 единиц, а с концентрациями 0,01н. скачок изменяется от 5 до 9 единиц рН (рис. 1). Оптимальными в методе нейтрализации являются концентрации 0,1 моль/л, так как с разбавленными растворами уменьшается скачок, а с более концентрированными растворами увеличивается «капельная ошибка», связанная с внесением в конце титрования избыточной капли рабочего раствора.
Рассматривая кривую титрования 0,1 н. раствора соляной кислоты 0,1 н. раствором щелочи, видим, что точка эквивалентности совпадает в данном случае с нейтральной точкой (рН = 7). Очевидно, что может быть употреблен такой индикатор, окраска которого меняется при рН = 7, то есть как раз в точке эквивалентности данного титрования, например лакмус или бромтимоловый синий, показатели титрования которых лежат около 7. Однако, учитывая скачок рН на кривой титрования, видим, что можно применять, например, метилоранж, хотя с ним титрование заканчивают не при рН = 7, а при рН ≈ 4. Действительно, из таблицы и рис.1. видно, что рН = 4 достигается в тот момент, когда прибавлено 99,9 мл раствора NаОН. Следовательно, индикаторная ошибка титрования составляет 0,1 мл на 100 мл или 0,1% недотитрованности. С фенолфталеином титрование заканчивают при рН ≈ 9, и раствор перетитровывается на величину, меньшую 0,1 мл на 100 мл, что соответствует индикаторной ошибке менее 0,1 %. Отсюда следует основное правило выбора индикатора: для каждого данного титрования можно применять только те индикаторы, показатели титрования которых лежат в области скачка рН на кривой титрования.
При титровании 0,1 н. растворов сильных кислот сильными основаниями (или обратно) можно применять индикаторы, с показателями титрования от 4 до 10: метиловый оранжевый (рТ≈4,0), метиловый красный (рТ ≈ 5,5), лакмус (рТ ≈ 7), фенолфталеин (рТ ≈ 9), тимолфталеин (рТ≈10). Если же концентрации растворов будут равны 0,01н., то скачок рН лежит в пределах от 5 до 9. Поэтому метилоранж (рТ≈4) и тимолфталеин (рТ≈10) применять нельзя. В этом случае подойдут только такие индикаторы, как метиловый красный (рТ ≈ 5,5), лакмус (рТ ≈ 7), фенолфталеин (рТ ≈ 9).
Скачок является очень важной характеристикой кривой титрования. Если на кривой титрования скачка нет, не удается подобрать индикатор и, следовательно, прямое титрование оказывается невозможным.
100 % оттитрованности 100 % оттитрованности
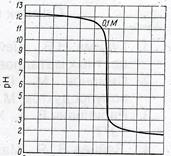
Рис. 1. Кривые титрования раствора Рис. 2. Кривая титрования 0,1 н.
HCl раствором NaOH в зависимости раствора NaOH 0,1 н. раствором HCl
от концентраций
Кривая титрования 0,1 н. раствора сильного основания 0,1 н. раствором сильной кислоты приведена на рис. 2, из которого следует, что скачок рН лежит также в интервале от 10 до 4 и титрование возможно с теми же индикаторами: метилоранж, метиловый красный, лакмус, фенолфталеин, тимолфталеин.
Контрольные вопросы
1.Какие точки определяют «скачок» на кривой титрования?
2.Какие способы подбора индикаторов можно применять в методе нейтрализации?
3.Какие факторы влияют на величину скачка на кривой титрования?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 127 – 131.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.98 - 99.
С.Б. Денисова, О.И. Михайленко
Дата добавления: 2016-09-20; просмотров: 1507;
