РН – Индикаторы – это слабые органические кислоты или основания, изменяющие окраску с изменением рН раствора.
Окраска органического соединения определяется его молекулярным строением, и соответственно изменение окраски происходит в результате внутримолекулярной перегруппировки, изменяющей строение молекулы индикатора. Окраска органических соединений обусловлена присутствием в молекуле особых функциональных групп – хромофоров. К ним относятся цепочка сопряженных одинарных и двойных углерод - углеродных связей, в которую могут быть включены хиноидная и другие группы (>C=O, -N=O,
-N=N-, >C=N-), содержащие гетероатомные двойные связи. Наличие цепочки сопряженных двойных связей приводит к тому, что молекула взаимодействует с электромагнитным излучением, избирательно поглощая волну, соответствующую видимой области спектра. На окраску органических соединений влияет также присутствие другого рода групп, называемых ауксохромами. В отличие от хромофоров, ауксохромы сами по себе не способны сообщать окраску соединению, но, присутствуя совместно с хромофорами, и участвуя как донорные группы в сопряжении двойных связей, они усиливают их действие, углубляя окраску, вызванную хромофорами. Важнейшими ауксохромами являются группы -ОН и -NH2, а также их производные, содержащие различные радикалы, например группы -ОСН3,
-N(СН3)2, -N(С2Н5)2 и т. д.
Например, фенолфталеинотносится к кислотным индикаторам. Одно из трех бензольных ядер, входящих в молекулу фенолфталеина, претерпевает хиноидную перегруппировку, и в растворе устанавливается равновесие:
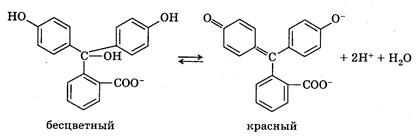
При введении в раствор ионов ОН– равновесие сдвигается вправо. Следствием этого является изменение окраски фенолфталеина.
Метиловый оранжевый относится к основным индикаторам. При диссоциации молекулы метилового оранжевого образуют амфотерные ионы («амфионы»), несущие одновременно как положительные, так и отрицательные заряды. Эти ионы накапливаются при подкислении раствора и придают ему красную окраску. При подщелачивании раствора происходит взаимодействие указанных амфотерных ионов с ионами ОН–, сопровождающееся изменением строения индикатора и переходом его окраски из красной в желтую:
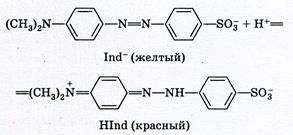
Таким образом, с изменением рН раствора форма существования индикатора в растворе изменяется. Условно можно записать следующее уравнение диссоциации для рН - индикатора:
HInd  H+ + Ind–
H+ + Ind–
молекулярная ионная
кислотная форма щелочная форма
С добавлением щелочи положение равновесия диссоциации индикатора смещается вправо, в щелочной среде индикатор существует преимущественно в ионной щелочной форме. При добавлении кислоты равновесие диссоциации индикатора смещается влево, в кислой среде индикатор существует преимущественно в молекулярной кислотной форме. Кислотная и щелочная формы индикатора имеют разные окраски. Например, лакмус содержит индикаторную кислоту, молекулы HInd которой красного цвета, а анионы – Ind–синего.Изменение окраски рН - индикаторов происходит при введении в раствор ионов Н+ или ОН–. Следовательно, окраска индикаторов зависит от величины рН. Связь между окраской рН-индикатора и величиной рН раствора можно вывести из константы диссоциации рН - индикатора.
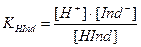 ,
, 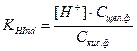 ,
, 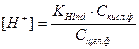 ,
,
где Сщел ф = [Ind–] – молярная концентрация щелочной формы; Скисл ф = [HInd] – молярная концентрация кислотной формы рН – индикатора.
Решая уравнение относительно [H+] и логарифмируя, получим:
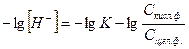 ; (1)
; (1)
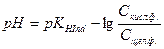 , (2)
, (2)
где рKHInd = –lgKHInd - показатель константы диссоциации индикатора.
Глаз имеет ограниченную способность к восприятию окрасок и перестает замечать присутствие одной из окрашенных форм индикатора наряду с другой его формой, если концентрация ее в 10 раз меньше концентрации последней. Если Cкисл.ф/Cщел.ф ≥ 10, наблюдается окраска только кислотной формы. И наоборот, если Cкисл..ф/Cщел..ф ≤ 10-1, наблюдается окраска только щелочной формы. Если 10-1≤ Cкисл.ф/Cщел.ф ≤ 10, в растворе присутствуют две формы в сравнимых количествах и раствор приобретает смешанную окраску. Окраска любого индикатора изменяется не при всяком изменении рН, а лишь внутри определенного интервала значений рН, называемого областью перехода окраски индикатора, которая может быть выражена формулой ∆рН=рKHInd ± 1. Титрование с индикатором завершают при определенной окраске. То значение рН, при котором заканчивается титрование с данным индикатором, называется показателем титрования индикатора:рТ ≈ рНконца титр. Если величина рТ не дана, можно принять, что она лежит в середине области перехода, то есть приблизительно равна показателю константы диссоциации индикатора рКHInd.
| Индикатор | Область перехода | рТ=рНконца титр | Окраска индикатора | |
| кислотной формы | щелочной формы | |||
| Метиловый оранжевый | 3,1-4,4 | 4,0 | красная | желтая |
| Метиловый красный | 4,4-6,2 | 5,5 | красная | желтая |
| Лакмус | 5,0-8,0 | 7,0 | красная | синяя |
| Фенолфталеин | 8,0-10,0 | 9,0 | бесцветная | малиновая |
Интервал перехода окраски индикатора зависит только от свойств данного индикатора и не зависит от природы реагирующих между собой кислоты и основания. Изменение окраски индикатора происходит не строго в точке эквивалентности, а с отклонением от нее. Такое отклонение влечет за собой ошибку, называемую индикаторной ошибкой титрования. При правильном выборе индикатора ошибка не выходит за обычные пределы аналитических погрешностей (≈0,1%).
рН - Индикаторы должны удовлетворять следующим требованиям:
1) окраска индикатора должна быть интенсивной;
2) окраски двух форм резко различаются;
3) изменение окраски должно быть обратимым и быстрым;
4) изменение окраски происходит в узком интервале рН;
5) индикатор должен быть устойчивым в растворе и на воздухе.
Контрольные вопросы
1.Какие индикаторы используются в методе нейтрализации?
2.Как объяснить изменение окраски индикатора по ионной теории?
3.В чем особенность хромофорной теории индикаторов?
4.Что называется показателем титрования?
5.Как определить область перехода окраски индикатора?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 117 – 122.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.84 - 98.
О.Б. Чалова
Дата добавления: 2016-09-20; просмотров: 3374;
