Лекция 6. Область применения метода нейтрализации. Рабочие растворы в методе нейтрализации
Ключевые слова: метод нейтрализации, рабочие растворы, точка эквивалентности,
кислотно-основное титрование.
К методу нейтрализации относят все анализы, в основе которых лежит реакция кислотно-основного взаимодействия. По этому методу можно, пользуясь титрованным раствором какой-либо сильной кислоты, проводить количественное определение оснований (ацидиметрия) или, пользуясь титрованным раствором щелочи, количественно определять кислоты (алкалиметрия). Метод нейтрализации может быть использован для определения солей, подвергающихся гидролизу, и проявляющих кислотно-основные свойства.
При титровании раствора любой кислоты раствором щелочи, концентрация Н+ - ионов постепенно уменьшается, а рН раствора – возрастает. При определенном значении рН достигается точка эквивалентности и прибавление щелочи должно быть прекращено. При титровании раствора основания раствором кислоты рН раствора уменьшается. Величина рН в точке эквивалентности зависит от природы реагирующих веществ (кислоты и основания) и от их концентраций. Например, титрование сильной кислоты сильной щелочью протекает по схеме
НСl + NаОН → NaСl + Н2О.
В точке эквивалентности в растворе будет только образовавшаяся при реакции соль (NаСl) без избытка кислоты или щелочи. Соли сильных кислот и сильных оснований не подвергаются гидролизу и имеют нейтральную реакцию. Следовательно, в точке эквивалентности в рассматриваемом случае рН равен 7. То же будет, очевидно, и при титровании сильной щелочи сильной кислотой.
Однако если сильную кислоту заменить слабой, например, уксусной кислотой, то при титровании происходит следующая реакция:
СН3СООH + NаОН → СН3СООNa + Н2O.
В точке эквивалентности в растворе будет присутствовать соль СН3СООNа, гидролиз которой протекает по схеме
СН3СОО– + H2О  СН3СООН + OH–.
СН3СООН + OH–.
Гидролиз ацетата натрия сопровождается накоплением ионов ОН– и приводит к возникновению щелочной реакции раствора. Следовательно, заканчивать титрование уксусной кислоты нужно не при рН=7, как в случае титрования НСl, а при рН>7.
При титровании слабых оснований сильными кислотами
NH4OH + HCl → NH4Cl + H2O
в точке эквивалентности реакция раствора определяется гидролизом соли по катиону, приводящим к накоплению ионов Н+:
NH4+ + H2O  NH4OH + H+ .
NH4OH + H+ .
Следовательно, при титровании слабого основания сильной кислотой рН в точке эквивалентности должен быть меньше 7 (рН<7).
Итак, в разных случаях титрование приходится заканчивать при различных значениях рН, зависящих от природы реагирующих между собой кислоты и основания, а также от их концентраций. Очень важно правильно выбрать рабочий раствор, индикатор и способ титрования.
Рабочими растворами (титрантами) в методе нейтрализации являются растворы сильных кислот (HCl, H2SO4) и/или растворы щелочей (NаОН или КОН). И те, и другие не являются стандартными веществами, поэтому их растворы нельзя приготовить по точной навеске. Рабочий раствор в методе нейтрализации готовят разбавлением концентрированного раствора, объем которого рассчитывается по соотношению 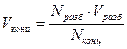 .
.
После чего точную концентрацию рабочего раствора устанавливают титрованием стандартных исходных веществ. Для установки титров кислот в качестве исходных веществ применяют химически чистые буру (тетраборат натрия - Na2B4O7·10H2O) или карбонат натрия (Na2CO3). Реакции протекают соответственно по уравнениям:
Na2B4O7·10H2O + 2HCl → 4H3BO3 + 2NaCl + 5H2O;
fэкв(Na2B4O7·10H2O) = ½; М(ЭNa2B4O7·10H2O) = М(Na2B4O7·10H2O)/2=190,7 г/моль.
Na2CO3 + 2HCl → 2NaCl + H2CO3;
fэкв(Na2CO3) = ½; М(ЭNa2CO3) = М(Na2CO3)/2 = 53 г/моль.
Продуктами реакции являются слабые кислоты (H3BO3 и H2CO3), следовательно, в точке эквивалентности в растворе среда кислая, поэтому титрование проводят в присутствии метилоранжа. Точную концентрацию кислоты рассчитывают по соотношениям:
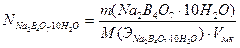 ;
; 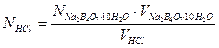 .
.
Для установки титра щелочей используют щавелевую кислоту H2C2O4·2H2O или янтарную кислоту H2C4H4O4, например:
H2C2O4·2H2O +2NaOH → Na2C2O4· + 4H2O
fэкв(H2C2O4·2H2O) = ½; М(ЭH2C2O4·2H2O) = М(H2C2O4·2H2O)/2 = 63 г/моль.
Контрольные вопросы
1.Рабочие растворы метода нейтрализации.
2.Чем определяется рН в точке эквивалентности?
3.Какие вещества применяют в качестве исходныхпри установке
титров кислот и щелочей?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 68 – 75, 125 – 127.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.81 – 84, 125-127.
Ф.Н. Латыпова, С.Ю. Шавшукова
Дата добавления: 2016-09-20; просмотров: 9083;
