Лекция 5. Общие приемы титрования. Закон эквивалентов. Расчеты в титриметрическом анализе.
Ключевые слова: метод пипетирования, метод отдельных навесок, прямое титрование, обратное титрование, титрование заместителя, закон эквивалентов.
В титриметрическом анализе концентрацию определяемого вещества рассчитывают по известным объемам реагирующих веществ и известной концентрации титранта. Титрование, как при определении концентрации, так и при выполнении анализов можно проводить двумя различными методами:
1. Метод пипетирования: навеску исходного (или анализируемого) вещества растворяют в мерной колбе, разбавляют водой до метки и тщательно перемешивают. Пипеткой отбирают отдельные порции раствора (аликвоты), переносят в колбу для титрования и титруют рабочим раствором.
2. Метод отдельных навесок:навеску исходного (или анализируемого) вещества растворяют в произвольном объеме растворителя в колбе для титрования, целиком оттитровывая полученный раствор.
В титриметрии используют три способа титрования: прямое, обратное и титрование заместителя.
В случае прямого титрования определяемое вещество А в процессе титрования непосредственно реагирует с раствором титранта В:
А + В ® продукты реакции.
Расчет результатов титриметрического анализа основан на законе эквивалентов, в соответствии с которым вещества реагируют между собой в строго определенных эквивалентных количествах. В точке эквивалентности:
nэкв(A) = nэкв(B) или NA·VA = NB·VB.
Это важное следствие из закона эквивалентов применяется при всех расчетах в титриметрии. Массу вещества А, вступившего в реакцию, рассчитывают для метода отдельных навесок по формуле 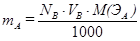 .
.
В том случае, если для анализа берут не весь раствор анализируемого вещества Vмк, а только часть его – аликвоту - Vп (метод пипетирования), предыдущее уравнение умножают на отношение (Vмк/Vп).
Обратное титрование (титрование по остатку) используется в тех случаях, когда реакция между веществами А и В протекает медленно или нет подходящего индикатора для фиксирования точки эквивалентности. В этом случае к раствору определяемого вещества А добавляют точно отмеренный, но заведомо избыточный объем титранта В и после завершения реакции между ними остаток вещества В оттитровывают рабочим раствором D.
А + В(избыток) ® продукты реакции + В(остаток),
В(остаток) + D ® продукты реакции.
Количество молей эквивалентов определяемого вещества - nэкв(А) - в этом случае равно разности между количеством молей эквивалентов веществ В и D:
nэкв(А) = [nэкв(В) – nэкв(D)], откуда 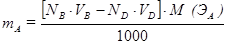 .
.
Например, количественное определение солей аммония нельзя провести прямым титрованием щелочью из-за отсутствия скачка на кривой титрования. Поэтому к анализируемому раствору добавляют точное количество щелочи (избыток). Остаток щелочи титруют рабочим раствором соляной кислоты.
Титрование заместителя (заместительное титрование) применяют в том случае, когда невозможно провести прямое титрование. В этом случае сначала проводят реакцию определяемого вещества А с избытком вспомогательного реагента D, в результате чего получается соединение А'(заместитель), способное реагировать с титрантом В в строго эквивалентном соотношении:
А + D ® продукты реакции + А',
А' + В ® продукты реакции.
Количество молей эквивалентов при титровании заместителя А' всегда равно количеству моль эквивалентов титранта В и равно количеству молей эквивалентов определяемого вещества А:
nэкв(А) = nэкв(А') = nэкв(В) = NB·VB.
Расчет массы тА осуществляется по формуле, аналогичной формуле, используемой для расчетов результата прямого титрования.
Например, невозможно анализировать окислители прямым титрованием раствором йодида калия. В данном случае применяется метод замещения, в результате которого один окислитель замещается другим окислителем – йодом, а последний титруется тиосульфатом натрия.
K2Cr2O7 + 6KI + 7H2SO4 = 3I2 + 4K2SO4 + Cr2(SO4)3 + 7H2O;
2Na2S2O3 + I2 = Na2S4O6 + 2NaI .
Затраченный на титрование объем Na2S2O3 эквивалентен выделившемуся в первой реакции I2, а последний эквивалентен K2Cr2O7. Расчет массы или нормальности K2Cr2O7 основан на законе эквивалентов:
nэкв(K2Cr2O7) = nэкв(I2) = nэкв(Na2S2O3) = NNa2S2O3·VNa2S2O3.
Контрольные вопросы
1. В чем суть метода пипетирования и метода отдельных навесок?
2. Сформулируйте закон эквивалентов.
3. Охарактеризуйте способ прямого титрования и приведите для него формулы расчета результатов анализа.
4. Охарактеризуйте способ обратного титрования и приведите для него формулы расчета результатов анализа.
5. Охарактеризуйте способ титрования заместителя и приведите для него формулы расчета результатов анализа.
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 60 – 88.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 76 - 80.
Ф.Н. Латыпова, С.Ю. Шавшукова
Дата добавления: 2016-09-20; просмотров: 10708;
