Лекция 2. Ошибки в количественном анализе и статистическая обработка результатов анализа
Ключевые слова: параллельные определения; погрешность измерения; погрешности систематические, случайные и промахи; выборка, варианта выборки, объем выборки; среднее арифметическое; Q-критерий; размах варьирования; точность, воспроизводимость, правильность анализа; стандартное отклонение; доверительная вероятность и доверительный интервал; критерий Стьюдента; точные и приближенные числовые значения.
Любое измерение имеет свою определенную погрешность, связанную с точностью измерительной аппаратуры и особенностями метода.
Оценка погрешности результата является частью анализа. Погрешность измерения- отклонение результата измерений xi от истинного значения измеряемой величины хтеор.
Абсолютная погрешность:∆абс = xi - xтеор.
Относительная погрешность:∆отн = (|∆абс|/ xтеор)·100%.
По своему характеру погрешности делятся на следующие:
1. Систематические - погрешности, вызываемые причинами, действующими одинаковым образом при многократном повторении измерений (недостатки метода анализа, неисправность прибора, присутствие в реагентах веществ, мешающих определению, погрешности самого экспериментатора); их можно заранее предусмотреть, устранить или ввести на них поправку.
2. Случайные - неопределенные по величине и знаку погрешности, в появлении которых не наблюдается какой-либо закономерности. Для минимизации и численной оценки этих погрешностей анализ повторяют несколько раз, т.е. проводят параллельные (повторные) определения – измерения одной и той же величины для одной аналитической пробы в одинаковых условиях.
Совокупность результатов параллельных измерений называют выборкой. Сами результаты называют вариантами выборки. Число вариант, составляющих выборку, называют объемом выборки. На основе параллельных измерений рассчитывают среднее арифметическое –сумму вариант, деленную на объем выборки n:
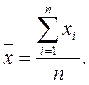
Грубые погрешности(промахи) – отдельные значения, резко отличающиеся от остальных и, как правило, полученные в условиях грубого нарушения аналитической методики. Промахи выявляют среди серии результатов повторных измерений, как правило, с помощью Q-критерия. Для его расчета результаты параллельных определений выстраивают в ряд по возрастанию их значений: х1, х2, х3,…, хn-1, хn. Сомнительным обычно является первый или последний результат в этом ряду. Q-критерий вычисляют как отношение взятой по абсолютной величине разности сомнительного результата и ближайшего к нему в ряду к разности последнего и первого в ряду. Разность хn - х1 называют размахом варьирования.
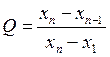 .
.
Для выявления промаха рассчитанное для него Q сравнивают с табличным критическим значением Qтабл, приведенным в аналитических справочниках. Если Q < Qтабл - результат остается, если Q > Qтабл, то сомнительный результат исключают из рассмотрения, считая промахом. Промахи должны быть выявлены и устранены.
Значения Q-критерия для различной доверительной вероятности P и числа измерений n приведены в таблице:
| n | P | n | P | ||||
| 0,90 | 0,95 | 0,99 | 0,90 | 0,95 | 0,99 | ||
| 0,89 | 0,94 | 0,99 | 0,43 | 0,51 | 0,64 | ||
| 0,68 | 0,77 | 0,89 | 0,48 | 0,55 | 0,68 | ||
| 0,56 | 0,64 | 0,76 | 0,44 | 0,51 | 0,64 | ||
| 0,48 | 0,56 | 0,70 | 0,41 | 0,48 | 0,60 |
Химический анализ характеризуется правильностью и воспроизводимостью, которые определяют его точность. Близкие значения определяемой величины в параллельных опытах говорят о воспроизводимости результатов. Если полученное среднее значение близко к истинному, то говорят о правильности результатов анализа.
Количественно воспроизводимость характеризуют стандартным отклонением S, определяемым методами математической статистики:
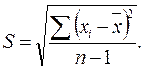
Стандартное отклонение S показывает, на какую в среднем величину отклоняются результаты n измерений от среднего значения. Кроме того, для оценки погрешности результата рассчитывают стандартное отклонение среднего арифметического:

Используя данные величины, оценивают диапазон значений, в котором с заданной вероятностью Р может находиться результат. Эта вероятность Р называется доверительной вероятностью (статистической надежностью). Обычно принимают Р=95%. Соответствующий данной вероятности интервал значений - доверительный интервал:
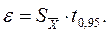
При расчетах используют специальный tα - критерий Стьюдента, определяющий ширину доверительного интервала, в котором может находиться результат анализа. Значения tα-критерия находят в специальных таблицах, учитывая число измерений и степень вероятности α (0,95 или 0,99) нахождения результатов анализа в данном доверительном интервале. Например, для α = 0,95 значения tα-критерия в зависимости от числа измерений n равны:
| n-1 | ||||||||||
| tα | 12,71 | 4,30 | 3,18 | 2,78 | 2,57 | 2,45 | 2,36 | 2,31 | 2,26 | 2,23 |
Представление полученного результата с доверительным интервалом: 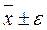 .
.
Числовые значения подразделяют на точные и приближенные. Значащими цифрами числа называют все его цифры, кроме нулей, стоящих слева до первой отличной от нуля цифры. Нули, стоящие в середине и в конце числа, являются значащими. Например, в числе 427,205 - 6 значащих цифр; 0,00365 - 3 значащие цифры; 244,00 - 5 значащих цифр.
Каждый результат анализа не может быть точнее, чем это позволяют измерительные приборы. Допустимое расхождение результатов параллельных определений обычно регламентируется ГОСТ, ОСТ или ТУ на конкретный анализ. В количественном химическом анализе применяют аналитические весы (погрешность взвешивания не более 0,0002 г) и мерную посуду, измеряющую объемы с точностью до сотых долей миллилитра. Считается, что при взвешивании на аналитических весах погрешность приблизительно равна 0,02%, при точном измерении объемов – 0,2%. Если погрешность вычислений не оговорена заранее, то следует иметь в виду, что точная концентрация вычисляется до 4-й значащей цифры, точная масса - до 4-го десятичного знака после запятой, точная массовая доля (процентное содержание) - до сотых долей. Если значащих цифр указано меньше, то значение является приближенным.
Контрольные вопросы
1. Что такое погрешность измерения? Как классифицируют погрешности?
2. Что такое параллельные определения, выборка, варианта и объем выборки?
3. Дайте определение промаха. Как его можно выявить?
4. Охарактеризуйте параметры, определяющие точность анализа.
5.Какие количественные параметры математической статистики используются для представления результата анализа?
6. Какие числовые значения являются точными, а какие приближенными? 7. Какие цифры являются значащими?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 24 - 49.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 7 - 25.
С.Б. Денисова, О.И. Михайленко
Лекция 3. Титриметрический анализ. Основные понятия и термины
Ключевые слова: титриметрические методы анализа, титрование, титрант (рабочий раствор), точка эквивалентности, растворы приготовленные и установленные, первичный стандарт (исходное вещество), фиксанал (стандарт-титр), индикатор, скачок титрования, конечная точка титрования, индикаторная ошибка.
Количественные методы анализа, основанные на точном измерении объема реагента точно известной концентрации, израсходованного на реакцию с определяемым веществом, называют титриметрическими. Титрование - процесс постепенного добавления раствора реагента точно известной концентрации (титранта, рабочего раствора, стандартного раствора) к определяемому веществу до момента, при котором количество титранта эквивалентно количеству определяемого вещества, то есть до точки эквивалентности. Достижение точки эквивалентности можно определить:
1) с помощью индикатора – специального реактива, обладающего способностью изменять свою окраску при изменении концентрации определяемого вещества вблизи точки эквивалентности;
2) безындикаторным способом - визуально по резкому изменению какого-либо видимого свойства системы (появление, изменение или исчезновение окраски, образование или растворение осадка);
3) с помощью инструментальных методов (наблюдая за изменением оптической плотности, рН, потенциала электрода, силы тока и др.).
Выбор индикатора осуществляют: а) по методу построения кривых титрования либо б) по методу расчета индикаторной ошибки.
Кривая титрования выражает графическую зависимость изменения какого-либо свойства системы (рН, потенциал и др.) от объема добавленного титранта. При этом на кривой титрования имеются области плавного (до и после точки эквивалентности) и резкого (вблизи точки эквивалентности) изменения свойства системы. Резкое изменение свойства называется скачком титрования. Границы скачка устанавливаются с точностью 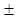 0,1 % оттитрованности, что соответствует погрешности титриметрического анализа. Момент, при котором заканчивается титрование с выбранным индикатором, называют конечной точкой титрования. Даже при правильно выбранном индикаторе теоретически рассчитанная точка эквивалентности не совпадает с практически установленной конечной точкой титрования. Это приводит к возникновению индикаторной ошибки.
0,1 % оттитрованности, что соответствует погрешности титриметрического анализа. Момент, при котором заканчивается титрование с выбранным индикатором, называют конечной точкой титрования. Даже при правильно выбранном индикаторе теоретически рассчитанная точка эквивалентности не совпадает с практически установленной конечной точкой титрования. Это приводит к возникновению индикаторной ошибки.
В зависимости от способа получения различают рабочие растворы приготовленные и установленные. Растворы, полученные по точной навеске вещества, называют приготовленными. Вещество, по точной навеске которого можно непосредственно приготовить рабочий раствор, называют первичным стандартом (исходным веществом); к нему предъявляется ряд требований:
1) вещество должно быть химически чистым; 2) состав вещества должен точно соответствовать формуле; 3) вещество должно быть устойчивым при хранении как в твердом виде, так и в растворе; 4) должно быть хорошо растворимо и 5) должно иметь возможно большую молярную массу эквивалента. Кроме того, рабочие растворы могут быть приготовлены из фиксаналов (стандарт-титров) - запаянных ампул с количеством вещества, необходимым для приготовления 1 л точно 0,1 или 0,01 н. раствора.
Если вещество не отвечает требованиям к первичному стандарту, то по его навеске готовят раствор с примерно желаемой концентрацией, которую точно устанавливают в процессе титрования раствора с точно известной концентрацией. Такие растворы называют установленными. Концентрация этих растворов, как правило, с течением времени меняется, поэтому ее необходимо проверять через определенные промежутки времени (1-3 недели).
Для титриметрических определений можно использовать реакции раз-личных типов, но все они должны удовлетворять следующим требованиям:
1. Реакции должны проходить быстро, а состояние равновесия наступать практически мгновенно.
2. Реакции должны протекать до конца и количественно.
3. Реакции должны протекать стехиометрически, посторонние продукты не должны мешать титрованию.
4. Должен иметься способ фиксирования точки эквивалентности.
Методы титриметрического анализа классифицируют по типу реакций, лежащих в основе определения веществ:
| Метод | Протекающая реакция | Титрант |
| Кислотно-основное титрование | Сопровождается переносом протона | HCl, H2SO4 NaOH, KOH и др. |
| Окислительно-восстано-вительное титрование | Сопровождается переносом электрона и изменением степени окисления | KMnO4, I2, Na2S2O3, K2Cr2O7 и др. |
| Осадительное титрование | Образование малорастворимых электролитов | AgNO3, Hg2(NO3)2 и др. |
| Комплексонометрическое титрование | Образование малодиссоциирующих комплексных соединений | Комплексоны |
Контрольные вопросы
1. Что такое титрование, титрант, точка эквивалентности?
2. Охарактеризуйте способы фиксирования точки эквивалентности.
3. Чем отличаются приготовленные и установленные рабочие растворы?
4. Что такое первичный стандарт и каковы требования к нему?
5. Перечислите требования к реакциям в титриметрии.
6. Приведите классификацию методов титриметрии.
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 68 – 71.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 68 - 72.
С.Б. Денисова, О.И. Михайленко
Дата добавления: 2016-09-20; просмотров: 5372;
