Титр вещества (Т(B)) показывает, какая масса вещества B в г содержится в 1 мл раствора (г/мл): .
Соотношение между NB и Т(B) определяется формулами:
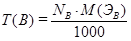 ;
; 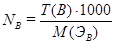 .
.
5. Титр рабочего раствора по определяемому веществу показывает, какое количество (г) определяемого вещества А соответствует или реагирует с 1 мл раствора титранта В (г/мл):
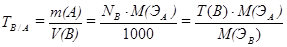 .
.
Титр рабочего раствора по определяемому веществу применяют, если проводится большое число параллельных анализов.
В некоторых случаях не стремятся получить раствор точно требуемой концентрации, навеску вещества берут не точно теоретически рассчитанную, а близкую к расчетной по величине, и вводят понятие поправочный коэффициент (К), который показывает, во сколько раз концентрация данного раствора больше или меньше выбранной концентрации. Поправочный коэффициент равен отношению величины практически взятой навески (концентрации, титра) к теоретически вычисленной:
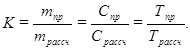
В этом случае в расчетах используют концентрацию, равную произведению поправочного коэффициента на выбранную концентрацию, например: N(точн) = N·К = 0,1·1,048 = 0,1048 н.
Контрольные вопросы
1. Перечислите способы выражения концентрации раствора, приведите формулы расчета и размерности для различных концентраций.
2. Дайте определение эквиваленту вещества и фактору эквивалентности. 3. Как рассчитывают фактор эквивалентности в различных реакциях?
4. Что такое поправочный коэффициент и как он рассчитывается?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 60 - 88.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 72 - 75.
С.Б. Денисова, О.И. Михайленко
Дата добавления: 2016-09-20; просмотров: 2116;
