Лекция 11. Кривая титрования слабого основания сильной кислотой
Ключевые слова: кривая титрования слабого основания сильной кислотой.
При построении кривой титрования слабого основания сильной кислотой исходят из тех же соображений, что и в случае титрования слабой кислоты щелочью. В первоначальный момент рН раствора определяется диссоциацией слабого основания. До точки эквивалентности в растворе будет присутствовать буферная смесь, состоящая из неоттитрованного слабого основания и его соли. В точке эквивалентности находится только соль слабого основания и сильной кислоты, которая подвергается гидролизу по катиону и создает кислую среду. За точкой эквивалентности рН определяется избыточным содержанием в растворе сильной кислоты.
Например, построим кривую титрования 100,0 мл 0,1 н. NH4OH раствором 0,1 н. HCl.
1 участок: до начала титрования.В первоначальный момент (без добавления HCl) в растворе присутствует слабое основание, которое обратимо диссоциирует:
NH4OH  NH4+ + OH- .
NH4+ + OH- .
рН исходного раствора слабого основания рассчитывают, используя его константу диссоциации: 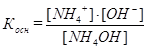 .
.
В растворе на каждый образующийся гидроксид-ион приходится один катион основания: [OН–] = [NH4+].
Если степень диссоциации основания <5% и выполняется условие Косн/СМ(осн) < 10-2, то можно принять, что [NH4OH] ≈ СМ(осн), тогда
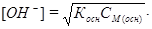
Расчет рН проводят по формуле
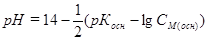 .
.
Для 0,1 н. NH4OH: рН = 14 - ½(4,76 – lg0,1) = 11,12.
2 участок: от начала титрования до точки эквивалентности.Добавлено некоторое количество HCl (VHCl <100 мл). В растворе присутствуют недотитрованное слабое основание NH4OH и его соль NH4Cl, полученная в результате протекания реакции:
NH4OH + HCl → NH4Cl + H2O.
Соль NH4Cl является сильным электролитом, полностью диссоциирующим на ионы, следовательно, [NH4+] ≈ СМ(соли).
Диссоциация слабого основания в присутствии одноименного иона (NH4+) подавлена, поэтому [NH4OH] ≈ СМ(осн).
Таким образом, в растворе до точки эквивалентности присутствуют слабое основание и соль, образованная этим основанием и сильной кислотой – основная буферная смесь. Концентрацию OН– находят из выражения для константы диссоциации слабого основания, используя допущенные приближения:
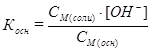 , отсюда
, отсюда 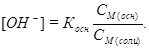
Поскольку исходные концентрации кислоты и основания одинаковые, отношение молярных концентраций оставшегося основания и образовавшейся соли в растворе определяется соотношением объемов:
СМ(осн)/ СМ(соли) = [100 - VHCl]/(VHCl).
Поэтому до точки эквивалентности расчет рН ведут по формуле для основной буферной смеси:
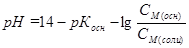 ;
; 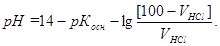
Дата добавления: 2016-09-20; просмотров: 4660;
