Лекция 12. Кривая титрования слабой кислоты слабым основанием
Ключевые слова: кривая титрования слабой кислоты слабым основанием.
При титровании слабых кислот слабыми основаниями (или наоборот) кислотная часть кривой титрования отвечает случаю титрования слабой кислоты сильным основанием. Щелочная часть кривой титрования совпадает с кривой титрования слабого основания сильной кислотой.
Например, титруют уксусную кислоту раствором NН4ОН:
СН3СООН + NH4ОН → СН3СООNH4 + H2O.
Образующаяся соль гидролизуется по катиону и по аниону одновременно по уравнению
СН3СОО– + NH4+ + H2O  NH4ОН + СН3СООН,
NH4ОН + СН3СООН,
откуда 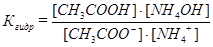 .
.
Умножив числитель и знаменатель на ионное произведение воды
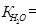 [H+][OH–], получим
[H+][OH–], получим 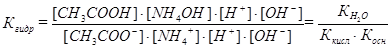 .
.
В точке эквивалентности [NH4OH] = [CH3COOH], а [NH4+] = [CH3COO–] ≈ Ссоли.
Тогда 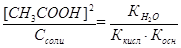 .
.
Выразив [CH3COOH] из уравнения константы диссоциации кислоты
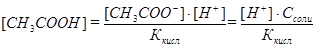 ,получаем
,получаем 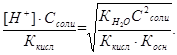
Откуда 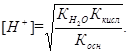
Логарифмируя и меняя знаки на обратные, получаем формулу для расчета рН в точке эквивалентности - в растворе соли слабой кислоты и слабого основания:
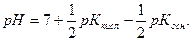
Так, в рассматриваемом случае, поскольку рКкисл=4,73, а рКосн=4,75,
рН = 7 + 2,37 − 2,38=6,99.
Независимо от концентрации соли, рН раствора в точке эквивалентности практически равен 7. Однако это происходит только в случае, если реагирующие между собой кислота и основание примерно одинаковой силы, то есть когда рКкисл ≈ рКосн. Если кислота сильнее (рКкисл<рКосн), то рН раствора соли меньше семи и раствор имеет слабокислую реакцию. В противном случае рН>7 и раствор соли будет иметь слабощелочную среду.
Поскольку рассматриваемый случай не представляет практического интереса, вычисления кривой титрования опустим и приведем только кривую:
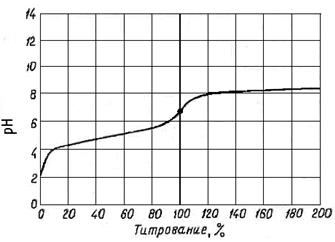
Кривая титрования 0,1н. раствора
СН3СООН 0,1 н. раствором NН4ОН
Как видно из рисунка, в случае титрования слабого электролита слабым электролитом скачок рН отсутствует совершенно. Этого и следовало ожидать, так как при титровании слабой кислоты сильным основанием сужается интервал скачка на кривой в области кислотных значений рН. Наоборот, при титровании слабого основания сильной кислотой интервал скачка уменьшается в щелочной области рН. Поэтому при титровании слабой кислоты слабым основанием, сужение интервала скачка происходит и в кислотной, и в щелочной областях рН. Вследствие этого интервал скачка рН на кривой титрования вовсе исчезает. Поэтому в данном случае нельзя ожидать и резкого изменения окраски индикатора. Это значит, что точно провести такое титрование ни с каким из известных индикаторов невозможно.
Очевидно, что титрование слабой кислоты слабым основанием вообще невозможно.
Для того чтобы можно было титровать не только сильные, но и слабые кислоты или основания, в качестве рабочих растворов метода нейтрализации употребляются обязательно растворы сильных оснований и кислот.
Контрольные вопросы
1. Как выглядит кривая титрования при титровании слабого электролита слабым электролитом?
2. Как рассчитывают рН в точке эквивалентности при титровании слабой кислоты слабым основанием?
4. Всегда ли совпадает рассчитанное значение с точкой нейтральности?
5. Почему невозможно провести титрование слабой кислоты слабым основанием (или наоборот)?
Список рекомендуемой литературы
1. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 106 - 108.
2. Алексеев В.Н. Количественный анализ. - М.: Химия, 1972. – С. 288 – 290.
А.Т. Чанышева
Дата добавления: 2016-09-20; просмотров: 5307;
