Лекция 14. Водородная и гидроксидная индикаторные погрешности титрования
Ключевые слова:индикаторная ошибка титрования, рН в точке эквивалентности,
водородная индикаторная погрешность, гидроксидная индикаторная погрешность.
Наряду с построением кривых титрования существует другой способ выбора индикатора, заключающийся в расчете индикаторной ошибки титрования. Для титрования выбирают индикатор, показатель титрования которого возможно ближе подходит к величине рН в точке эквивалентности, и вычисляют для него индикаторную ошибку титрования.
Индикаторная ошибка титрования это погрешность, которая обусловлена несовпадением показателя титрования рТ применяемого индикатора и, следовательно, рН в конце титрования с величиной рН в точке эквивалентности. Вследствие этого несовпадения раствор обычно либо перетитровывают (положительная погрешность), либо, наоборот, недотитровывают (погрешность отрицательная). В результате по окончании титрования раствор содержит некоторый избыток свободной кислоты или свободного основания.
Тип индикаторной погрешности определяется свойствами вещества, остающегося в растворе по окончании титрования. Если избыточная кислота является сильной и, следовательно, присутствует в растворе в виде свободных ионов Н+, погрешность называют «водородной», или «Н+ - ошибкой». Если кислота является слабой и присутствует почти исключительно в виде недиссоциированных молекул (НА), ошибку называют «кислотной погрешностью», или «НА-ошибкой». Аналогично, если избыточное основание является сильным, оно обусловливает возникновение «гидроксидной погрешности», или «ОН− - ошибки». Если основание слабое – ошибку называют «основной погрешностью», или «МеОН-ошибкой».
Водородная индикаторная погрешность может возникнуть при недотитровывании сильной кислоты (в таком случае погрешность отрицательная) либо когда сильная кислота используется в качестве рабочего раствора и добавлена в избытке (положительная погрешность).
Водородную ошибку можно оценить следующим образом. Титрование заканчивается при рН, равном показателю титрования (рТ) взятого индикатора. Например, при рН ≈ 4 в случае метилового оранжевого или при рН ≈ 9 в случае фенолфталеина. В момент окончания титрования концентрация ионов Н+ может быть вычислена из соотношения рТ = - lg[H+] и [H+] = 10-рТ [моль/л].
В образовавшемся по окончании титрования объеме V2 раствора количество вещества (моль)избыточной кислоты равно n(Н+)изб = 10-рТ·V2.
В исходном растворе количество вещества кислоты (n(Н+)нач, моль)было
n(Н+)нач = N·V1.
Чтобы выразить водородную ошибку в процентах от исходного количества сильной кислоты, составляем пропорцию.
n(Н+)нач = N·V1 (моль) составляет 100%
n(Н+)изб = 10-рТ ·V2 (моль) ~ х%
Отсюда водородная ошибка (δН+) равна δН+ = 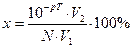 .
.
Если концентрации титруемого раствора и титранта одинаковы, то V2 =2·V1, следовательно, δН+ = 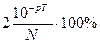 .
.
Гидроксидная индикаторная погрешность может возникнуть при недотитровывании сильного основания (в таком случае погрешность отрицательная) либо когда сильная щелочь используется в качестве рабочего раствора и добавлена в избытке (положительная погрешность).
Гидроксидную ошибку можно рассчитать на основании рассуждений, аналогичных предыдущим. В конце титрования концентрация ионов ОН- может быть вычислена из соотношения
рТ = рН; рОН = 14 – рН = 14 – рТ; рОН= - lg[ОH-].
Следовательно, в конце титрования: [ОH-] = 10-(14 – рТ) [моль/л].
В образовавшемся по окончании титрования объеме V2 раствора количество вещества (моль)избыточной щелочи равно n(ОН-)изб = 10-(14-рТ)·V2.
В исходном растворе количество вещества щелочи (n(ОН-)нач, моль)было
n(ОН-)нач = N·V1.
Чтобы выразить гидроксидную ошибку в процентах от исходного количества сильной щелочи, составляем пропорцию.
n(ОН-)нач = N·V1 (моль) составляет 100%
n(ОН-)изб = 10-(14-рТ)·V2 (моль) ~ х%
Отсюда гидроксидная ошибка (δОН-) равна δОН- = 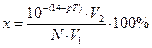 .
.
Если концентрации титруемого раствора и титранта одинаковы, то V2 =2 V1, следовательно, δОН- = 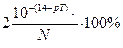 .
.
Пример 1. Чему равна индикаторная ошибка титрования 0,1 н. раствора НСl 0,1 н. раствором NаОН с метиловым оранжевым?
Решение. Выясним, с какой из ошибок в данном случае приходится считаться. Точка эквивалентности достигается в рассматриваемом случае при рН=7, а заканчивается титрование с метиловым оранжевым при рН≈4. Значит, раствор по окончании титрования будет содержать некоторое количество избыточной НС1. Поскольку эта кислота сильная, она вызовет δН+-ошибку.
Так как нормальность обоих растворов одинакова, на реакцию затрачиваются равные объемы растворов. Это значит, что объем раствора при титровании удвоится, то есть V2=2·V1. Отсюда
δ 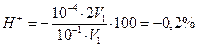 .
.
Знак минус означает, что исследуемый раствор HCl недотитрован. Так как величина 0,2% не выходит за обычные пределы аналитических погрешностей, индикатор метилоранж в этом случае применить можно.
Пример 2. Чему равна индикаторная ошибка титрования 0,1 н. раствора НСl 0,1 н. раствором NаОН с фенолфталеином?
Решение. Применяя фенолфталеин, заканчивают титрование при рН≈9, то есть раствор НСl будет перетитрован. Поскольку титрующая щелочь сильная, возникает δОН−-ошибка. Следовательно, δ 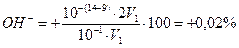 .
.
Таким образом, фенолфталеин можно использовать для титрования.
Пример 3. Можно ли титровать 0,01 н. соляную кислоту 0,01 н. гидроксидом натрия с метиловым оранжевым?
Решение. С метилоранжем кислота недотитровывается, и возникает водородная ошибка. Следовательно, δ 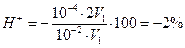 .
.
Ошибка недопустимо велика. Значит, титровать 0,01 н раствор соляной кислоты 0,01 н раствором щелочи с метиловым оранжевым нельзя. При применении фенолфталеина δОН−-ошибка будет равна +0,2%, и, значит, фенолфталеин пригоден для титрования 0,01 н. раствора соляной кислоты
0,01 н. раствором щелочи.
Поскольку рН-индикаторы имеют кислотно-основную природу, переход индикатора из одной формы в другую требует расхода реагента. С уменьшением количества индикатора эта ошибка уменьшается, поэтому при титровании рекомендуется применять минимальное количество индикатора. На изменение окраски индикатора оказывает влияние ряд факторов: концентрация индикатора, присутствие электролитов и других веществ в растворе, растворенный СО2, а также температура и так называемые спиртовая и белковая ошибки.
Контрольные вопросы
1.Что такое индикаторная ошибка?
2.Какого типа индикаторные ошибки могут возникать при титровании?
3.Что такое водородная индикаторная погрешность и как она
рассчитывается?
4.Что такое гидроксидная индикаторная погрешность и как она
рассчитывается?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 133 – 136.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.121 - 122.
О.Б. Чалова,А.Т. Чанышева
Дата добавления: 2016-09-20; просмотров: 8300;
