Лекция 15. Кислотная и основная индикаторные погрешности титрования
Ключевые слова:показатель титрования индикатора, рН в точке эквивалентности,
кислотная индикаторная погрешность титрования, основная индикаторная
погрешность титрования.
Кислотная погрешность (δHA)вызвана присутствием в растворе недотитрованной слабой кислоты и имеет отрицательное значение. Для вычисления кислотной погрешности составим выражение для константы диссоциации слабой кислоты и преобразуем это выражение:
НА  Н+ + А-
Н+ + А-
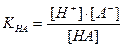 ;
; 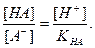
Поскольку НА кислота слабая, концентрация недиссоциированных молекул кислоты - [НА] - практически равна общей концентрации свободной кислоты в растворе. Величина [А−] равна концентрации полученной соли. В результате нейтрализации 1 моля кислоты образуется 1 моль соли. Следовательно, отношение [НА]/[А−] можно рассматривать как отношение концентрации неоттитрованной части кислоты к оттитрованной ее части, и оно позволяет оценить величину кислотной ошибки титрования (δНА). Поскольку [Н+]=10−рT, а KНА=10−рК, из приведенного выше уравнения находим
δ 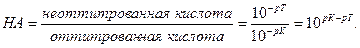
Если титрование необходимо провести так, чтобы индикаторная ошибка титрования не превышала 0,1%, то есть чтобы оставшаяся неоттитрованная кислота составляла не более 0,001 от количества оттитрованной кислоты, нужно, чтобы 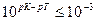 или
или 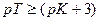 .
.
Значит, в тех случаях, когда применение данного индикатора вызывает возникновение кислотной ошибки титрования, он пригоден только при условии, если величина показателя титрования индикатора рТ не менее, чем на 3 единицы, превышает величину показателя диссоциации кислоты рК.
Например, достаточно точно оттитровать уксусную кислоту (рКкисл=4,73) можно только при применении таких индикаторов, показатель титрования которых рТ≥7,73. Значит, ни метиловый оранжевый (рТ≈4), ни метиловый красный (рТ≈5,5), ни лакмус (рТ≈7) не подходят. Наоборот, фенолфталеин (рТ≈9) можно использовать для титрования уксусной кислоты щелочью.
Величина кислотной погрешности в процентах (%) представляет собой молярную долю неоттитрованной кислоты и может быть рассчитана через соотношение
δНА(%) = 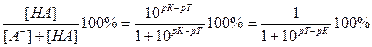 .
.
Основная погрешность титрования(δМеОН) вызвана присутствием в растворе недотитрованного слабого основания, как правило, имеет отрицательное значение. Учитывая диссоциацию слабого основания, составим выражение для константы диссоциации и преобразуем его.
МеОН  Ме+ + ОН-.
Ме+ + ОН-.
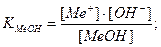
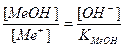 ;
;
δМеОН = 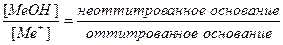 .
.
В конце титрования рН = рТ, а рОН =(14−рТ), и [OH-] = 10-(14-pT). Следовательно: δ 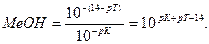
Достаточно точным титрование может быть при условии, если δМеОН-ошибка равна или меньше величины 10−3, то есть если 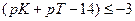 или
или
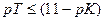 . Например, при титровании NН4ОН (рKосн = 4,75) можно применить индикаторы с рТ≤6,25. Следовательно, ни фенолфталеин (рТ≈9), ни лакмус (рТ≈7) не подойдут. Наоборот, метиловый красный (рТ≈5,5) и метиловый оранжевый (рТ≈4) можно использовать для титрования NН4ОН раствором сильной кислоты.
. Например, при титровании NН4ОН (рKосн = 4,75) можно применить индикаторы с рТ≤6,25. Следовательно, ни фенолфталеин (рТ≈9), ни лакмус (рТ≈7) не подойдут. Наоборот, метиловый красный (рТ≈5,5) и метиловый оранжевый (рТ≈4) можно использовать для титрования NН4ОН раствором сильной кислоты.
Величина основной погрешности в процентах (δМеОН(%)) представляет собой молярную долю неоттитрованного основания и может быть рассчитана через соотношение
δМеОН(%) = 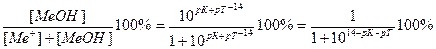 .
.
Пример 1. Вычислить ошибку титрования 0,1 н. раствора уксусной кислоты 0,1 н. раствором гидроксида натрия с индикаторами: а) метиловым оранжевым; б) фенолфталеином.
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 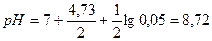 .
.
А. Титрование с метиловым оранжевым заканчивается при рН≈4. По окончании титрования в растворе будет присутствовать избыточная уксусная кислота СН3СООН. А так как это кислота слабая, она вызовет δНА-ошибку:
δ 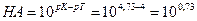 =5,4.
=5,4.
Это значит, что неоттитрованная часть уксусной кислоты относится к оттитрованной ее части, как 5,4 к 1. Другими словами, из 6,4 части первоначально взятой СН3СООН остаются неоттитрованными 5,4 части. Отсюда легко вычислить δНА-ошибку в процентах, составив пропорцию:
6,4 − 100%
5,4 − х% . Следовательно: δНА(%) = 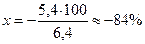 .
.
Вывод - титровать уксусную кислоту с метилоранжем нельзя. Тот же вывод можно получить без вычислений, применяя соотношение рТ≥(рК+3). Можно использовать индикаторы, для которых рТ≥ (4,76 + 3) = 7,76. Для метилоранжа это условие не выполняется: рТ≈4 < 7,76.
Б. Поскольку рН в точке эквивалентности равен 8,72, а рТ фенолфталеина равен рТ≈ 9,0, с фенолфталеином раствор СН3СООH будет перетитрован. Так как титрующая щелочь − сильная, возникает δОН−-ошибка:
δ 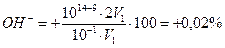 .
.
Фенолфталеин можно использовать для титрования уксусной кислоты щелочью.
Пример 2. Чему равна индикаторная ошибка титрования 0,1 н раствора NН4ОН 0,1 н раствором НСl с индикаторами: а) фенолфталеином, б) метиловым оранжевым?
Решение. Для определения типа ошибки вычисляем рН раствора в точке эквивалентности: 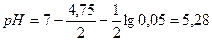 .
.
А. Титрование с фенолфталеином заканчивается при рН≈9; в растворе по окончании титрования будет некоторый избыток NН4ОН. Поэтому в данном случае возникает δМеОН-ошибка: δ 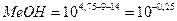 = 0,56.
= 0,56.
Следовательно, из 1,56 весовых частей первоначально взятого NН4ОН не оттитрованными остаются 0,56 весовой части. Составим и решим пропорцию:
1,56 — 100%
0,56 — х% Следовательно: δМеОН(%) = 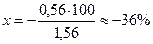 .
.
Индикатор фенолфталеин непригоден для титрования гидроксида аммония сильной кислотой. Тот же вывод получаем при применении соотношения для индикаторов: рТ≤(11−pK) = 11 – 4,76 = 6,24.
Тогда как для фенолфталеина рТ≈9 > 6,24.
Б. В случае титрования NН4ОН с метиловым оранжевым титрование заканчивается при рН≈4,0 вместо рН=5,28. В этом случае возникает δН+-ошибка: δ 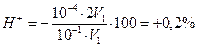 . Следовательно, индикатор метиловый оранжевый можно использовать для титрования NН4ОН сильной кислотой.
. Следовательно, индикатор метиловый оранжевый можно использовать для титрования NН4ОН сильной кислотой.
Контрольные вопросы
1.В каком титровании возникает кислотная индикаторная погрешность?
2.В каком титровании возникает основная индикаторная погрешность?
3.Как рассчитывается кислотная индикаторная погрешность?
4.Как рассчитывается основная индикаторная погрешность?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 139 – 140, 149 – 151.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.123 - 125.
О.Б. Чалова
Дата добавления: 2016-09-20; просмотров: 6138;
