Лекция 18. Кривая титрования ортофосфорной кислоты
Ключевые слова: многоосновные кислоты, кривая титрования ортофосфорной кислоты.
Многоосновные кислоты можно рассматривать как смесь двух и более кислот, значительно различающихся по силе, поскольку К1 > К2 > К3.
Раздельные скачки на кривых титрования многоосновных кислот наблюдаются в том случае, если отношение двух констант диссоциации не менее 104 . Если отношение констант намного меньше указанного, изменение рН в первой точке эквивалентности будет слишком мало и этот скачок нельзя использовать для точных определений. Например, так как
К1H2С2O4/ К2H2С2O4 = (5,6·10-2/5,4·10-5) = 1,04·103 < 104,
для точного определения щавелевой кислоты можно использовать только вторую точку эквивалентности. Щавелевая кислота титруется щелочью по двум стадиям в присутствии фенолфталеина:
Н2С2О4 + 2NaOH → Na2С2О4 + 2Н2О.
Ортофосфорная кислота является трехосновной и диссоциирует в водном растворе по трем стадиям.
1 стадия: H3PO4  H+ + H2PO4-
H+ + H2PO4-
2 стадия: H2PO4-  H+ + HPO42-
H+ + HPO42-
3 стадия: HPO42-  H+ + PO43-.
H+ + PO43-.
Соответствующие константы диссоциации равны:
К1H3PO4 =7,1·10-3; (рК1 = 2,15);
К2 H3PO4 = 6,2·10-8; (рК2 = 7,21);
К3 H3PO4 = 5,0·10-13; (рК3 = 12,30).
По первой стадии диссоциации ортофосфорная кислота средней силы, по второй – слабая и по третьей – очень слабая.
Нейтрализация ортофосфорной кислоты раствором щелочи протекает ступенчато – в три стадии. В соответствии с этим на кривой титрования присутствуют три точки эквивалентности и можно ожидать три скачка для каждой последовательной стадии нейтрализации кислоты. Рассмотрим кривую титрования для 100 мл 0,1М раствора ортофосфорной кислоты 0,1М раствором гидроксида натрия.
В растворе ортофосфорной кислоты рНопределяется 1-й стадией диссоциации и рассчитывается через К1H3PO4. Вторая и третья стадии диссоциации не учитываются, так как подавлены.
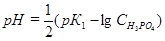 ,
,
где CH3PO4 - молярная концентрация ортофосфорной кислоты.
При добавлении гидроксида натрия протекает первая стадия нейтрализации:
Н3РО4 + NaOH → NaH2PО4 + Н2О.
От начала титрования до первой точки эквивалентностиортофосфорная кислота в избытке, гидроксид натрия нейтрализует ее по первой стадии не полностью.
В растворе присутствует буферная смесь (Н3РО4 + NaH2PО4), для которой
рН = рК1 – lg(CH3PO4/CNaH2PO4),
где CNaH2PO4 - молярная концентрация дигидрофосфата натрия.
В первой точке эквивалентности вся ортофосфорная кислота оттитрована по первой стадии, в растворе присутствует только кислая соль NaH2PО4, и рН рассчитывается по соотношению
рН(NaH2PО4) = 1/2·(рК1 + рК2) = ½ (2,15 + 7,21) = 4,68.
Поскольку отношение констант:
(К1H3PO4/ К2H3PO4) = (7,1·10-3/6,2·10-8) = 105,06 > 104 и К1H3PO4 =7,1·10-3 > 10-7 в первой точке эквивалентностина кривой титрования присутствует скачок и возможно дифференцированное титрование ортофосфорной кислоты по первой стадии нейтрализации до дигидрофосфата.
После первой и до второй точки эквивалентности происходит нейтрализация по второй стадии:
NaН2РО4 + NaOH → Na2HPО4 + Н2О.
В растворе присутствуют буферная смесь слабая «кислота» NaН2РО4- и ее соль Na2HPО4. Значение рН раствора рассчитывается приблизительно по формуле
рН = рК2 – lg(CNaH2PO4/CNa2HPO4),
где CNa2HPO4 - молярная концентрация гидрофосфата натрия.
Во второй точке эквивалентности вся ортофосфорная кислота оттитрована по второй ступени и в растворе присутствует кислая соль Na2HPО4, для которой: рН(Na2HPО4) = 1/2·(рК2 + рК3) = ½(7,21 + 12,30) = 9,76.
Поскольку отношение констант:
(К2H3PO4/К3H3PO4) = (6,2∙10-8/5,0∙10-13) = 105,09 > 104 и К2H3PO4 =6,2 10-8 ≈ 10-7 во второй точке эквивалентностина кривой титрования присутствует небольшой скачок и возможно дифференцированное титрование ортофосфорной кислоты по второй стадии нейтрализации до гидрофосфата.
После второй до третьей точки эквивалентности анионы НРО42- титруются щелочью до РО43-, протекает третья стадия нейтрализации в соответствии с уравнением
Na2НРО4 + NaOH → Na3PО4 + Н2О.
В растворе присутствует буферная смесь: недотитрованная очень слабая «кислота» Na2НРО4 и ее соль Na3PО4. Значение рН раствора рассчитывается приблизительно по формуле
рН = рК3 – lg(CNa2HPO4/CNa3PO4),
где CNa3PO4 - молярная концентрация ортофосфата натрия.
В третьей точке эквивалентностиортофосфорная кислота полностью оттитрована по трем стадиям. В растворе присутствует ортофосфат натрия Na3PО4, который подвергается сильному гидролизу по аниону (примерно на 30%) и, следовательно:
рН(Na3PО4) = 7 + 1/2·(рК3 + lgCNa3PO4) = 7 + ½(12,30 + lg(0,1·100/400) = 12,35.
Поскольку К3H3PO4 = 5,0 10-13 < 10-7, в третьей точке эквивалентности скачок отсутствует, и оттитровать ортофосфорную кислоту по трем стадиям невозможно.
После третьей точки эквивалентности значение рН раствора определяется избытком прибавленного рабочего раствора щелочи и рассчитывается по соотношению (см. лекцию 9):
рН = 14 + lgC΄М(NaOН).
Кривая титрования 0,1М раствора ортофосфорной кислоты 0,1М раствором гидроксида натрия показана на рисунке.
 рН
рН
100 200 300 VNaOH, мл
Кривая титрования 0,1М раствора Н3РО4 0,1М раствором NaOH
Результаты вычислений значений рН в ходе титрования 0,1М Н3РО4 раствором 0,1М NaOH приведены в таблице:
| Добавлено 0,1 М NaOH, мл | ||||||||||
| pH | 1,72 | 2,22 | 4.15 | 4,67 | 5,21 | 7,21 | 9,21 | 9,80 | 12,3 | 12,35 |
| Характерные точки | 1-я точка экв. | 2-я точка экв. | 3-я точка экв. |
Контрольные вопросы
1.Охарактеризуйте кислотные свойства Н3РО4.
2.Сколько стадий нейтрализации ортофосфорной кислоты?
3.Сколько скачков присутствует на кривой титрования Н3РО4?
4.Возможно ли раздельное (дифференцированное) титрование ортофосфорной кислоты по 1-й стадии?
5.Возможно ли раздельное (дифференцированное) титрование ортофосфорной кислоты по двум стадиям?
6.Какие индикаторы применяют для титрования Н3РО4?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 144 – 147.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 110 - 114.
О.Б. Чалова
Дата добавления: 2016-09-20; просмотров: 13844;
