Лекция 16. Определение аммиака в солях аммония
Ключевые слова: кривая титрования, обратное титрование, метод Кьельдаля, заместительное титрование, формальдегидный метод.
Катион аммония NH4+ проявляет очень слабые кислотные свойства, за счет гидролиза: NH4+ + H2O  NH4OH + H+
NH4OH + H+
Процесс характеризуется константой гидролиза:
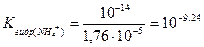 < 10-7.
< 10-7.
Поскольку константа очень мала, на кривой титрования соли аммония щелочью скачок отсутствует и его прямое титрование щелочью с применением рН-индикатора невозможно. Поэтому для определения аммиака (NH3) в солях аммония (NH4+) применяют косвенные методы анализа: обратное титрование или заместительное титрование.
В первом вариантеметода обратного титрования к анализируемому раствору добавляют избыток точно отмеренного титрованного раствора NaOH и нагревают до полного удаления NH3 из раствора.
NH4Cl + NaOH → NH3↑ + NaCl + H2O.
Окончание удаления аммиака (≈30 мин) определяют по влажной индикаторной бумаге, ее вносят в пары над нагреваемой колбой с раствором. По окончании удаления всего аммиака индикаторная бумага не синеет.
Оставшееся количество щелочи определяют титрованием стандартным раствором кислоты (например, HCl) в присутствии метилоранжа.
NaOH(остаток) + HCl → NaCl + H2O.
Фенолфталеин в качестве индикатора не применяется, так как возможно искажение результата за счет взаимодействия щелочи с СО2.
Расчет результатов анализа проводят по закону эквивалентов.
1 способ. Если известны концентрации растворов кислоты и щелочи, по результатам титрования рассчитывают объем щелочи (VNaOH(остаток)), пошедший на реакцию с кислотой (HCl), по соотношению
VNaOH(остаток) = (NHCl·VHCl)/NNaOH,
где NNaOH – нормальная концентрация рабочего раствора щелочи; NHCl – нормальная концентрация рабочего раствора кислоты; VHCl – объем рабочего раствора кислоты, пошедший на титрование в присутствии метилоранжа; VNaOH – избыточный объем добавленного рабочего раствора щелочи.
Объем раствора щелочи, пошедший на реакцию с NH4Cl, равен разности:
VNaOH(на NH4Cl) = (VNaOH - VNaOH(остаток)).
Следовательно: nэкв(NH3) = nэкв(NH4Cl) = nэкв(NaOH) = NNaOH·VNaOH(на NH4Cl),
где nэкв - количество эквивалентов указанных веществ, моль.
2 способ. Щелочь (NaOH) расходуется на взаимодействие с двумя веществами (NH4Cl и HCl), поэтому справедливо соотношение
nэкв(NaOH) = nэкв(NH4Cl) + nэкв(HCl).
Следовательно: nэкв(NH3) = nэкв(NH4Cl) = [nэкв(NaOH) - nэкв(HCl)];
nэкв(HCl) = NHCl·VHCl; nэкв(NaOH) = NNaOH·VNaOH.
Таким образом: nэкв(NH3) = [NNaOH·VNaOH - NHCl·VHCl].
Если концентрация щелочи неизвестна, в ходе анализа проводят контрольное титрование, в котором определяют объем кислоты (VHCl(контр)), необходимый для полной нейтрализации объема щелочи, взятого на анализ (VNaOH). В этом случае:
nэкв(NaOH) = NNaOH·VNaOH = NHCl·VHCl(контр).
nэкв(NH3) = [NHCl·VHCl(контр) - NHCl·VHCl] = NHCl [VHCl(контр) - VHCl]
Массу аммиака (m(NH3)) рассчитывают по формуле
m(NH3) = nэкв(NH3)·M(ЭNH3),
где M(ЭNH3) =17 г/моль – молярная масса эквивалента NH3.
Пример.К навеске соли аммония добавили 30,00 мл 0,1024 н раствора щелочи, прокипятили до полного удаления аммиака, после чего оттитровали 10,50 мл 0,09876 н раствора соляной кислоты. Рассчитать массу аммиака и массу азота, содержащегося в образце.
Решение.
VNaOH(остаток) = (NHCl·VHCl)/NNaOH = 0,09876·10,50/ 0,1024 = 10,13 мл;
VNaOH(на NH4Cl) = (VNaOH - VNaOH(остаток))= (30,00 – 10,13) = 19,87 мл;
nэкв(N) = nэкв(NH3) = nэкв(NH4Cl) = nэкв(NaOH)1 = NNaOH·VNaOH(наNH4Cl) = 0,1024·19,87/1000 = 2,035·10-3 моль;
m(NH3) = nэкв(NH3)·M(ЭNH3) = 2,035·10-3 ·17 = 0,03459 г.
m(N) = nэкв(N)·M(ЭN) = 2,035·10-3·14 = 0,02849 г.
В широко известном методе определения азота в органических соединениях по Кьельдалю используется второй вариант метода обратного титрования. Методом Кьельдаля можно определять азот в аминах, аминокислотах, алкалоидах, белках, пищевых продуктах и многих других азотсодержащих соединениях. Пробу органического вещества обрабатывают при нагревании концентрированной серной кислотой, в результате чего органические соединения окисляются до СО2 и Н2О, а азот переходит в (NH4)2SО4. После охлаждения к остатку - анализируемому раствору соли аммония - добавляют избыток щелочи:
(NH4)2SО4 + 2NaOH → 2NH3↑ + Na2SО4 + 2H2O.
Выделившийся аммиак отгоняют в точно измеренный избыточный объем (VHCl) титрованного раствора кислоты.
NH3 + HCl → NH4Cl.
Количество кислоты, оставшейся в растворе после взаимодействия с аммиаком, определяют титрованием щелочью c метилоранжем.
HCl(остаток) + NaOH → NaCl + H2O.
Применение фенолфталеина и других индикаторов с рТ > 7 недопустимо, так как в реакцию могут вступить ионы аммония, присутствующие в растворе. Результат анализа рассчитывают по закону эквивалентов для обратного титрования:
nэкв(NH3) = [NHCl·VHCl - NNaOH·VNaOH],
где VHCl – избыточный объем рабочего раствора кислоты;
VNaOH – объем рабочего раствора щелочи, пошедший на титрование в присутствии метилоранжа.
Одним из самых точных методов определения солей аммония является формальдегидный метод заместительного титрования. Он основан на реакции
4NH4C1 + 6СН2О → (CH2)6N4 + 6Н2О + 4НС1.
В результате реакции в количестве, эквивалентном соли аммония, образуется сильная кислота (HCl), которую титруют раствором щелочи в присутствии фенолфталеина
HCl + NaOH → NaCl + H2O.
Необходимо применять индикатор с рТ≈9, поскольку в результате реакции образуется слабое основание— гексаметилентетрамин ((CH2)6N4), и точка эквивалентности лежит при рН > 7.
Кроме того, формальдегид может быть загрязнен муравьиной кислотой в результате его окисления кислородом воздуха:
CH2O + [O] → CHOOH.
Муравьиная кислота также оттитровывается раствором щелочи с образованием формиата натрия, водный раствор которого имеет щелочную реакцию. Для введения поправки на содержание муравьиной кислоты проводят «холостой опыт» титрования образца формальдегида раствором щелочи в присутствии фенолфталеина.
CHOOH + NaOH → CHOONa + H2O.
Объем щелочи, пошедший на титрование образца формальдегида (VNaOH(мк)), вычитают из объема, пошедшего на титрование исследуемого раствора (VNaOH). Содержание аммиака рассчитывают по соотношению
nэкв(NH3) = nэкв(NH4Cl) = nэкв(HCl) = nэкв(NaOH) = NNaOH·(VNaOH - VNaOH(мк));
m(NH3) = nэкв(NH3)·M(ЭNH3).
Контрольные вопросы
1. Почему невозможно прямое титрование катионов аммония щелочью?
2. Метод обратного титрования для определения содержания аммиака в
солях аммония.
3. В каком случае и для чего проводят контрольное титрование щелочи?
4. Определение азота в органических соединениях по методу Кьельдаля.
5. Метод заместительного титрования (формальдегидный метод) для
определения содержания аммиака в солях аммония.
6. Что такое «холостой опыт» и для чего его проводят?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 159 – 161.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.126 - 128.
О.Б. Чалова
Дата добавления: 2016-09-20; просмотров: 12220;
