Участок: точка эквивалентности.
В точке эквивалентности (добавлено 100,0 мл 0,1 н. NaOH) в растворе присутствует только соль CH3COONa, образованная слабой кислотой и сильным основанием, которая подвергается гидролизу по аниону:
CH3COO- + H2O  CH3COOH + OH-.
CH3COOH + OH-.
рН гидролизующейся соли рассчитывается через ее Кгидр:
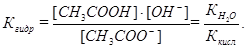
Так как [СН3СООН] = [ОН–], а при низкой степени гидролиза
[СН3СОО–] ≈ СМ(соли), поэтому
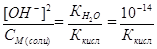 , откуда рОН = 7 - ½ рКкисл - ½lgСМ(соли) и
, откуда рОН = 7 - ½ рКкисл - ½lgСМ(соли) и
рН = 7 + ½ рКкисл + ½lgСM(соли).
4 участок: после точки эквивалентности.Добавлен избыток раствора NaOH, который присутствует в растворе вместе с образовавшейся при реакции солью CH3COONa. Гидролиз соли подавлен избыточным количеством гидроксид-ионов, наличие которых и определяет рН раствора на этом участке. После точки эквивалентности расчет рН ведется, как и в случае титрования сильной кислоты щелочью (см. лекцию 9): pOH = -lg[OH-] = - lg С΄M(NаОН);
pH = 14 - pOH; 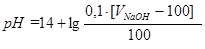 .
.
Результаты вычислений значений рН в ходе титрования слабой уксусной кислоты щелочью приведены в таблице:
| Добавлено 0,1 н. NaOH, мл | 0,0 | 10,0 | 50,0 | 90,0 | 99,0 | 99,9 | 100,0 | 100,1 | 101,0 | 110,0 | 150,0 | 200,0 |
| рН | 2,88 | 3,80 | 4,75 | 5,70 | 6,75 | 7,75 | 8,87 | 12,7 | ||||
| Характерные точки | Начало скачка | Точка экв. | Конец скачка |
Характерной особенностью кривых титрования слабых одноосновных кислот является несовпадение точки эквивалентности с точкой нейтральности, а также расположение точки эквивалентности в щелочной области рН на кривой титрования (рис. 1). Величина скачка на кривой титрования слабой уксусной кислоты щелочью (от 7,75 до 10) значительно меньше, чем в случае титрования сильной кислоты щелочью. В данном случае в качестве индикатора можно использовать только фенолфталеин, метилоранж применять нельзя. 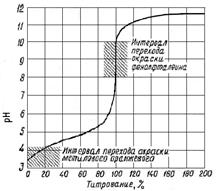
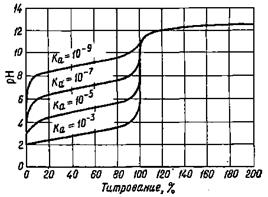
Рис. 1. Кривая титрования 0,1 н. раствора Рис. 2. Зависимость величины скачка на СН3СООН 0,1 н. раствором NaOH кривой титрования слабой кислоты щелочью
от константы диссоциации кислоты
Величина скачка уменьшается с уменьшением концентрации кислоты, с повышением температуры, а также с уменьшением константы диссоциации слабой кислоты. Влияние константы диссоциации слабой кислоты на величину скачка показано на рис 2. Скачок отсутствует, если Kкисл ≤ 10-7. Таким образом, прямое титрование и определение точки эквивалентности при помощи индикатора возможно только в том случае, если выполняется условие Kкисл·СМ(кисл) ≥ 10-8.
Контрольные вопросы
1. Приведите формулу расчета рН слабой кислоты до начала титрования.
2. По какой формуле рассчитывают рН титруемого раствора слабой кислоты щелочью до точки эквивалентности? Какая система при этом образуется?
3. Как рассчитывают рН в точке эквивалентности при титровании слабой кислоты щелочью? Совпадает ли рассчитанное значение с точкой нейтральности?
4. Как рассчитывают рН после точки эквивалентнсоти при титровании слабой кислоты щелочью?
5. Какие факторы влияют на величину скачка на кривой титрования при титровании слабой кислоты щелочью?
Список рекомендуемой литературы
1. Васильев В.П. Аналитическая химия. Кн. 1. Титриметрические и гравиметрический методы анализа. - М.: Дрофа, 2005. - С. 136 – 140.
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов. В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С. 102 - 106.
С.Б. Денисова, О.И. Михайленко
Дата добавления: 2016-09-20; просмотров: 1881;
