Явление радиоактивности
Радиоактивные превращения ядер
Строение вещества
Все в природе состоит из простых и сложных веществ. К простым веществам относятся химические элементы, к сложным – химические соединения. Известно, что вещества в окружающем нас мире состоят из атомов, которые являются наименьшей частью химического элемента. Атом – это мельчайшая частица вещества, определяющая его химические свойства, он имеет сложное внутреннее строение. В природе только инертные газы обнаруживаются в виде атомов, так как их внешние оболочки замкнутые, все остальные вещества существуют в виде молекул.
В 1911 г. Э. Резерфорд предложил планетарную модель атома, которая была развита Н Бором (1913 г.). По общепринятой модели строения атома в нем различают две области: тяжелое, положительно заряженное ядро, находящееся в центре, в котором сосредоточена почти вся масса атома, и легкую электронную оболочку, состоящую из отрицательно заряженных частиц – электронов, с огромной скоростью вращающихся вокруг ядра.
Электрон (е–)– устойчивая элементарная частица с массой покоя равной 9,1·10-31 кг или 0,000548 а.е.м. (атомная единица массы – это безразмерная величина атомной массы, которая показывает, во сколько раз атом данного элемента или частица тяжелее 1/12 части атома изотопа углерода-12; энергетический эквивалент 1 а.е.м. составляет 931 МэВ). Электрон несет один элементарный отрицательный заряд электричества (q=1,6·10-19 Кл), т. е. наименьшее количество электричества, встречающееся в природе. Исходя из этого заряд электрона принят за одну элементарную единицу электрического заряда.
В зависимости от энергии, которая удерживает электроны при вращении вокруг ядра, они группируются на разных орбитах (уровнях или слоях). Число слоев у различных атомов неодинаковое. В атомах с большой массой число орбит достигает семи. Их обозначают цифрами, или буквами латинского алфавита, начиная обозначение от ядра: K, L, M, N, O, P, Q. Число электронов в каждом слое строго определенное. Так, К-слой имеет не более 2 электронов, L-слой – до 8, M-слой – до 18, N-слой – 32 электрона и т. д.
Размеры атома определяются размерами его электронной оболочки, которая не имеет строго определенных границ. Приблизительно линейные размеры атома составляют 10-10 м.
Ядро – центральная массивная часть атома, состоящая из протонов и нейтронов, которая заряжена положительно. В ядре сосредоточена почти вся масса атома (более 99,95 %). Суммарное количество электронов на орбитах всегда равно сумме протонов в ядре. Например, атом кислорода содержит 8 протонов в ядре и имеет 8 электронов на орбитах, атом свинца – 82 протона в ядре и 82 электрона на орбитах. Вследствие равенства суммы положительных и отрицательных зарядов атом представляет собой электрически нейтральную систему. На каждый из движущихся вокруг ядра электронов действуют две равные, противоположно направленные силы: кулоновская сила притягивает электроны к ядру, а равная ей центробежная сила инерции стремится "вырвать" электрон из атома. Кроме того, электроны, двигаясь (вращаясь) вокруг ядра по орбите, одновременно обладают собственным моментом движения, который называют спином, упрощенно представляемый как вращение подобное волчку вокруг собственной оси. Спины отдельных электронов могут быть ориентированы параллельно (вращение в одну и ту же сторону) и антипараллельно (вращение в разные стороны). В упрощенном виде все это обеспечивает устойчивое движение электронов в атоме.
Известно, что на связь электрона с ядром действует не только кулоновская сила притяжения и центробежная сила инерции, но и сила отталкивания других электронов. Данный эффект называют экранировкой. Чем дальше электронная орбита от ядра, тем сильнее экранировка находящихся на ней электронов и тем слабее энергетическая связь ядро–электрон. На внешних орбитах энергия связи электронов не превышает 1-2 эВ, тогда как у электронов К-слоя она во много раз больше и возрастает с увеличением атомного номера элемента. Например, у углерода энергия связи электронов К-слоя составляет 0,28 кэВ, у стронция – 16 кэВ, у цезия – 36 кэВ, у урана – 280 кэВ. Поэтому электроны внешней орбиты больше подвержены воздействию внешних факторов, в частности, излучений низкой энергии. При сообщении электронам извне дополнительной энергии они могут переходить из одного энергетического уровня на другой или даже покидать пределы данного атома. Если энергия внешнего воздействия будет слабее энергии связи электрона с ядром, то электрон может только перейти с одного энергетического уровня на другой. Такой атом остается нейтральным, однако он отличается от остальных атомов этого химического элемента избытком энергии. Атомы, обладающие избытком энергии, называют возбужденными, а переход электронов с одного энергетического уровня на другой, более удаленный от ядра, – процессом возбуждения. Поскольку в природе любая система стремится перейти в устойчивое состояние при котором энергия ее будет наименьшей, то и атом через некоторое время переходит из возбужденного состояния в основное (первоначальное). Возвращение атома в основное состояние сопровождается выделением избыточной энергии. Переход электронов с внешних орбит на внутренние сопровождается излучением с длиной волны, характерной только для данного перехода с одного энергетического уровня на другой. Переходы электронов в пределах наиболее удаленных от ядра орбит дают излучение, состоящее из ультрафиолетовых, световых и инфракрасных лучей. При сильных внешних воздействия, когда энергия превышает энергию связи электронов с ядром, электроны вырываются из атома и удаляются за его пределы. Атом, лишившийся одного или нескольких электронов, превращается в положительный ион, а “присоединивший” к себе один или несколько электронов – в отрицательный ион. Следовательно, на каждый положительный ион образуется один отрицательный ион, т. е. возникает пара ионов. Процесс образования ионов из нейтральных атомов называется ионизацией. Атом в состоянии иона существует в обычных условиях чрезвычайно короткий промежуток времени. Свободное место на орбите положительного иона заполняется свободным электроном (электроном, не связанным с атомом), и атом вновь становится нейтральной системой. Этот процесс носит название рекомбинации ионов (деионизация) и сопровождается выделением избыточной энергии в виде излучения. Энергия, выделяющаяся при рекомбинации ионов, численно приблизительно равна энергии, затраченной на ионизацию.
Протон(р) – стабильная элементарная частица с массой равной 1,6725·10-27 кг или 1,00758 а.е.м., которая примерно в 1840 раз больше массы электрона. Заряд протона положителен и по величине равен заряду электрона. Атом водорода представляет собой ядро, содержащее один протон, вокруг которого вращается один электрон. Если “сорвать” этот электрон, то оставшаяся часть атома и будет протоном, поэтому протон часто определяют как ядро водорода.
Каждый атом любого элемента содержит в ядре определенное число протонов, которое постоянно и определяет физические и химические свойства элемента. Например, в ядре атома серебра их 47, в ядре урана – 92. Число протонов в ядре (Z) называют атомным номером или зарядовым числом, оно соответствует порядковому номеру элемента в периодической системе Д. И. Менделеева.
Нейтрон(n) – электрически нейтральная элементарная частица с массой незначительно превышающей массу протона и равной 1,6749•10-27 кг или 1,00898 а.е.м. Нейтроны устойчивы только в составе стабильных атомных ядер. Свободные нейтроны распадаются на протоны и электроны.
Нейтрон, вследствие своей электрической нейтральности, не отклоняется под действием магнитного поля, не отталкивается атомным ядром и, следовательно, обладает большой проникающей способностью, что создает серьезную опасность как фактор биологического действия излучения. Число нейтронов, находящихся в ядре, дает только в основном физическую характеристику элемента, так как в разных ядрах одного и того же химического элемента может быть разное число нейтронов (от 1 до 10). В ядрах легких устойчивых элементов число протонов относится к числу нейтронов как 1:1. С увеличением атомного номера элемента (начиная с 21-го элемента – скандия) в его атомах число нейтронов превышает число протонов. В самых тяжелых ядрах число нейтронов в 1,6 раза больше числа протонов.
Протоны и нейтроны – составные части ядра, поэтому для удобства их называют нуклонами. Нуклон(от лат. nucleus – ядро) – общее наименование для протонов и нейтронов ядра. Также, когда говорят о конкретном атомном ядре, используют термин нуклид. Нуклид – любое атомное ядро с заданным числом протонов и нейтронов.
Обозначая нуклиды или атомы, пользуются символом элемента, которому принадлежит ядро, и указывают сверху массовое число – А, внизу – атомный (порядковый) номер – Z в форме индексов 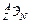 , где Э – символ химического элемента. А показывает число нуклонов, из которых состоит ядро атома (A = Z + N). Z показывает не только заряд ядра и порядковый номер, но и число протонов в ядре и соответственно число электронов в атоме, т.к. атом в целом нейтрален. N – число нейтронов в ядре, которое чаще всего не указывается. Например,
, где Э – символ химического элемента. А показывает число нуклонов, из которых состоит ядро атома (A = Z + N). Z показывает не только заряд ядра и порядковый номер, но и число протонов в ядре и соответственно число электронов в атоме, т.к. атом в целом нейтрален. N – число нейтронов в ядре, которое чаще всего не указывается. Например, 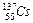 – радиоактивный изотоп цезия, А = 137, следовательно ядро состоит из 137 нуклонов; Z = 55, значит в ядре 55 протонов и, соответственно, 55 электронов в атоме; N = 137 - 55 = 82 – это число нейтронов в ядре. Порядковый номер иногда опускают, так как символ элемента вполне определяет его место в периодической системе (например, Cs-137, Не-4). Линейные размер ядра атома равны 10-15-10-14 м, что составляет 0,0001 диаметра всего атома.
– радиоактивный изотоп цезия, А = 137, следовательно ядро состоит из 137 нуклонов; Z = 55, значит в ядре 55 протонов и, соответственно, 55 электронов в атоме; N = 137 - 55 = 82 – это число нейтронов в ядре. Порядковый номер иногда опускают, так как символ элемента вполне определяет его место в периодической системе (например, Cs-137, Не-4). Линейные размер ядра атома равны 10-15-10-14 м, что составляет 0,0001 диаметра всего атома.
Протоны и нейтроны удерживаются внутри ядра силами, называемыми ядерными. По своей интенсивности они намного мощнее электрических, гравитационных и магнитных сил. Ядерные силы являются короткодействующими с радиусом действия 10-14–10-15 м. Они проявляются одинаково между протоном и нейтроном, протоном и протоном, нейтроном и нейтроном. С увеличением расстояния между нуклонами ядерные силы очень быстро уменьшаются и становятся практически равными нулю. Ядерные силы обладают свойством насыщения, т. е. каждый нуклон взаимодействует только с ограниченным числом соседних нуклонов. Поэтому при увеличении числа нуклонов в ядре ядерные силы значительно ослабевают. Этим объясняется меньшая устойчивость ядер тяжелых элементов, в которых содержится значительное число протонов и нейтронов.
Чтобы разделить ядро на составляющие его протоны и нейтроны и удалить их из поля действия ядерных сил, необходимо совершить работу, т.е. затратить энергию. Эта энергия называется энергией связи ядра. При образовании ядра из нуклонов наоборот выделяется энергия связи.
Если рассчитать массу ядра, например гелия, по формуле
mя = mpNp + mnNn,
где mя – масса ядра; mp – масса протона; Np – число протонов; mn – масса нейтрона; Nn – число нейтронов, то она будет равна 1,0076·2 + 1,0089·2 = 4,033 а.е.м.
Вместе с тем фактическая масса ядра гелия равна 4,003 а.е.м. Таким образом, фактическая масса ядра гелия оказывается меньше расчетной на величину 0,03 а.е.м. и в этом случае говорят, что ядро имеет дефект массы (недостаток массы). Разницу между расчетной и фактической массой ядра называют дефектом массы (Dm). Дефект массы показывает, насколько прочно связаны частицы в ядре, а также сколько энергии выделилось при образовании ядра из отдельных нуклонов. Связать массу с энергией можно с помощью уравнения, выведенного А. Эйнштейном:
DЕ = Dmс2,
где DЕ – изменение энергии; Dm – дефект массы; с – скорость света.
Учитывая, что 1 а.е.м. = 1,661 • 10-27 кг, а в ядерной физике за единицу энергии принят электрон-Вольт (эВ), причем 1 а.е.м. эквивалентна 931 МэВ, то энергия, которая выделится при образовании ядра гелия будет равна 28 МэВ. Если бы существовал способ разделения ядра атома гелия на два протона и два нейтрона, то для этого потребовалось бы затратить не менее 28 МэВ энергии.
Энергия связи ядер соразмерно возрастает с увеличением числа нуклонов, однако не строго пропорционально их числу. Например, энергия связи ядра азота – 104,56 МэВ, а урана – 1800 МэВ.
Средняя энергия связи, приходящаяся на один нуклон, называется удельной энергией связи. Для гелия она составит 28:4 = 7 МэВ. Если не считать самых легких ядер (дейтерий, тритий), то энергия связи на один нуклон составляет для всех ядер примерно 8 МэВ.
Большинство химических элементов в природе представляют собой определенные смеси атомов с ядрами различных масс. Различие масс обусловлено наличием в ядрах разного числа нейтронов.
Изотопы (от греч. isos – одинаковый и topos – место) – разновидности атома одного и того же химического элемента, которые имеют одинаковое число протонов (Z) и различное число нейтронов (N). У них практически одинаковые физические и химические свойства, разделить их в природной смеси очень сложно. Число изотопов элементов варьирует от 3 – у водорода до 27 – у полония. Изотопы бывают стабильные и нестабильные. Стабильные изотопы со временем не претерпевают никаких изменений, если нет воздействия из вне. Нестабильные или радиоактивные изотопы за счет процессов, протекающих внутри ядра, со временем превращаются в изотопы других химических элементов. Стабильные изотопы встречаются только у элементов с порядковым номером Z≤83. В настоящее время известно около 300 стабильных и более 2000 радиоактивных изотопов. Для всех элементов периодической системы Д. И. Менделеева синтезированы радиоактивные изотопы, называемые искусственными.
Явление радиоактивности
Все химические элементы стабильны лишь в узком интервале соотношения числа протонов к числу нейтронов в ядре. В легких ядрах должно быть примерно поровну протонов и нейтронов, т. е. величина соотношения n:p близка к 1, для тяжелых ядер это соотношение снижается до 0,7. Если в ядре слишком много нейтронов или протонов, то такие ядра становятся неустойчивыми (нестабильными) и претерпевают самопроизвольные радиоактивные превращения, в результате которых изменяется состав ядра и при этом испускаются заряженные или нейтральных частицы. Явление самопроизвольного излучения было названо радиоактивностью, а вещества, испускающие излучения, – радиоактивными.
Радиоактивность (от лат. radio – излучаю, radius – луч, aktivus – действенный) – это самопроизвольные превращения (распады) атомных ядер некоторых химических элементов в атомные ядра других элементов с испусканием особого рода излучения. Радиоактивность приводит к изменению атомного номера и массового числа исходного химического элемента.
Открытию явления радиоактивности способствовали два крупнейших открытия ХIХ века. В 1895 г. В. Рентген обнаружил лучи, которые возникали при пропускании тока высокого напряжения между электродами, помещенными в запаянную стеклянную трубку, из которой был откачан воздух. Лучи были названы рентгеновскими. А в 1896 г. А. Беккерель обнаружил, что соли урана самопроизвольно испускают невидимые лучи, обладающие большой проникающей способностью, вызывающие почернение фотопластинки и свечение некоторых веществ. Это излучение он назвал радиоактивным. В 1898 г. Пьер Кюри и Мария Склодовская-Кюри открыли два новых радиоактивных элемента – полоний и радий, которые испускали подобные излучения, но интенсивность их во много раз превышала интенсивность излучения урана. Кроме того было обнаружено, что радиоактивные вещества непрерывно выделяют энергию в виде теплоты.
Радиоактивные излучения также называют ионизирующими, так как они могут ионизировать среду, или ядерными, подчеркивая то, что излучение испускается ядром, а не атомом.
Радиоактивный распад связан с изменениями в атомных ядрах и выделением энергии, величина которой, как правило, на несколько порядков выше энергии химических реакций. Так, при полном радиоактивном распаде 1 г-атома 14С выделяется 3.109 калорий, тогда как при сгорании этого же количества 14С до углекислого газа выделяется лишь 9,4.104 калорий.
В качестве единицы энергии радиоактивного распада принимается 1 электрон-Вольт (эВ) и производные от него 1 кэВ = 103 эВ и 1 МэВ = 106 эВ. 1 эВ = 1,6.10-19 Дж. 1 эВ соответствует энергии, приобретаемой электроном в электрическом поле при прохождении пути, на котором разность потенциалов составляет 1 Вольт. При распаде большинства радиоактивных ядер высвобождаемая энергия составляет от нескольких кэВ до нескольких МэВ.
Радиоактивные явления, происходящие в природе, называют естественной радиоактивностью; аналогичные процессы, протекающие в искусственно полученных веществах (через соответствующие ядерные реакции), – искусственной радиоактивностью. Однако оба вида радиоактивности подчиняются одним и тем же законам.
Дата добавления: 2016-08-08; просмотров: 3466;
