ОСНОВЫ БИОЛОГИИ РЫБ 13 страница
клиническое обследование стада рыб;
патологоанатомическое вскрытие рыб;
лабораторные исследования.
Анамнестические и эпизоотологические данные, клинические признаки и патологоанатомические изменения чаще используют для постановки предварительного диагноза, а при некоторых болезнях они имеют решающее значение. Окончательный диагноз чаще ставится после проведения лабораторных исследований.
При подозрении на инфекционные заболевания проводят кли- нико-анатомические, вирусологические, бактериологические и микологические исследования, ставят биопробу.
При подозрении на инвазионные болезни необходимы клинический осмотр, патологоанатомическое и паразитологическое вскрытия.
При подозрении на отравления и незаразные болезни кроме клинико-анатомических проводят гидрохимические, химико-ток- сикологические (воды, рыбы, грунта, кормов и др.) исследования, ставят биопробы. При всех болезнях дополнительно проводят гематологические, биохимические, гистологические и другие диагностические исследования.
ВЕТЕРИНАРНО-САНИТАРНОЕ ОБСЛЕДОВАНИЕ РЫБОВОДНЫХ ХОЗЯЙСТВ
Обследование рыбоводных хозяйств (водоемов) проводят в плановом порядке для контроля выполнения противоэпизоотических мероприятий и вынужденно для установления диагноза при возникновении гибели рыб или подозрении на различные заболевания. В зависимости от целей и объема работ оно может быть полным или неполным.
Плановые обследования рыбоводных хозяйств проводят по полной схеме 2—3 раза в год. Целями таких обследований являются изучение эпизоотической ситуации и разработка ветеринарно-са- нитарных и профилактических мероприятий, а также контроль их выполнения. Они включают следующие работы:
проверка планов профилактических, лечебных и оздоровительных мероприятий и правильности их выполнения;
анализ санитарного состояния прудов, бассейнов, садков, аквариумного хозяйства, кормоцехов и других производственных помещений;
контроль методического уровня и условий для проведения диагностических исследований в местных лабораториях;
уточнение эпизоотического состояния и токсикологической ситуации в хозяйстве;
выборочное проведение необходимых диагностических исследований.
По результатам обследования составляется заключение о вете- ринарно-санитарном и эпизоотическом состоянии хозяйства, уточняется комплекс профилактических и оздоровительных мероприятий.
Неполное или вынужденное обследование проводят в случае возникновения заболевания рыб с целью его диагностики и разработки мероприятий по оздоровлению водоемов или хозяйства в целом. При этом основное внимание обращают на обследование неблагополучных водоемов, проведение клинических, патолого- анатомических, гидрохимических и других исследований в зависимости от предположительного диагноза, а также анализ документальных данных о перевозках, условиях содержания и кормления рыб, соблюдении рыбоводно-биологических нормативов их выращивания и т. п.
Начинают обследование со сбора анамнестических данных: опроса рыбоводов и обслуживающего персонала о течении болезни и гибели рыб, как она проявлялась, какие возрастные группы рыб болеют, при каких условиях возникло заболевание: метеорологических (паводок, дождь, перепад температуры и т. д.), гидрологических и гидрохимических, рыбоводных (пересадки, сортировка рыб). Поданным ветеринарного учета определяют, отмечалось ли подобное заболевание в предыдущие годы, какие диагностические исследования и профилактические мероприятия проводились, каковы их результаты. Изучают схему устройства хозяйства и водоснабжения прудов, определяют вероятные источники загрязнения водоемов.
В дальнейшем проводят обследование водоемов и стада пораженных рыб, которое включает: осмотр прудов (водоемов) и оценку санитарного состояния береговой зоны, зарастаемости ее растительностью, физических свойств воды; проведение клинического осмотра и патологоанатомического вскрытия рыб, учета больных и погибших рыб, определения уровня их заболеваемости; отбор воды и патматериалов для лабораторных исследований.
КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ СТАДА РЫБ
Клинический осмотр проводят выборочно непосредственно в водоеме, при контрольном отлове или посадке рыб в специальные емкости (аквариумы, садки, бассейны и т. п.). Рекомендуется просматривать не менее 100 рыб каждого вида и возраста. Регистрируют нарушение поведения рыб: пугливость, угнетение, возбуждение, координацию движения, равновесие в воде. Осматривают кожные покровы и плавники, обращая внимание на количество и качество слизи, изменение окраски, наличие припухлостей, кровоизлияний, язв, рубцов, цист, ерошение чешуи и т. д. Приподнимая жаберные крышки, осматривают жабры. Обращают внимание на окраску, форму, рисунок и степень ослизнения жабр, структуру лепестков, просматривая их с помощью лупы. На губах и слизистой ротовой полости встречаются кровоизлияния, язвы, новообразования. Важно не пропустить изменения на глазах: западания глаз или пучеглазие (экзофтальм), кровоизлияния, помутнение хрусталика и роговицы. Проводят учет больных рыб в абсолютном и процентном выражениях (заболеваемость).
Рыб с клиническими признаками отсаживают в ведра или другие емкости, переносят в лабораторию и проводят патологоанатомическое вскрытие, паразитологические и другие исследования. Для вскрытия берут 25 сеголетков, 10—15 двухлетков и единичные экземпляры рыб старшего возраста.
ПАТОЛОГОАНАТОМИЧЕСКОЕ ВСКРЫТИЕ РЫБ
Патологоанатомическое вскрытие имеет важное диагностическое значение. Его применяют при диагностике большинства болезней рыб. Вскрытию подвергают свежие трупы (жабры без признаков разложения) и живых рыб с клиническими признаками заболевания. С целью недопущения разноса заразного начала вскрытие рыб проводят в лаборатории или в другом помещении. Запрещается вскрывать рыб на берегу водоема, скармливать вскрытых рыб собакам, кошкам и другим животным. Вскрытых рыб подвергают утилизации или закапывают в землю после обеззараживания их хлорной известью. Живых рыб перед вскрытием обездвиживают разными способами: усыпляют гипнодилом (5—10 мг/л), хлоралгидратом (2,4 г/л), разрушают спинной мозг иглой или разрезом позвоночника в области затылка.
Патологоанатомическое вскрытие начинают с наружного осмотра, обращая внимание на те же изменения внешних покровов, плавников, глаз и других органов, что и при клиническом обследовании.
Вскрывают рыб в следующем порядке. Жабры обнажают удалением жаберной крышки ножницами. Отмечают степень ослизне- ния, изменения их окраски и рисунка, наличие кровоизлияний, очагов некроза, цист паразитов и т. д. Ножницами отрезают 2—3 дуги и просматривают их под лупой. Иногда готовят препараты отдельных лепестков на предметном стекле. Накрыв их покровным стеклом, определяют толщину складок и патологические изменения.
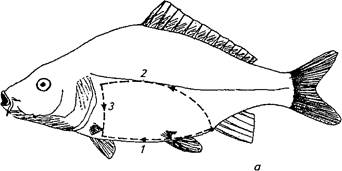
Брюшную полость карповых рыб вскрывают двумя разрезами (рис. 32). Ножницами делают надрез брюшной стенки впереди анального отверстия, вставляют тупой конец ножниц в брюшную полость и делают первый разрез вдоль белой линии до области межчелюстного пространства. Вторым полулунным разрезом, проходящим по уровню боковой линии, отсекают брюшную стенку, обнажая внутренние органы. Разрезы делают осторожно, чтобы не повредить внутренние органы. Вначале осматривают брюшную и сердечную полости, обращая внимание на их содержимое, наличие жидкости (транссудат или экссудат, ее количество, цвет, запах, консистенция) или газа, крупных паразитов, внешний вид внутренних органов. У половозрелых рыб отделяют гонады, отмечая стадию их зрелости, цвет, кровоизлияния, наличие мертвых икринок (белого цвета) и др. Затем, надрезав кишечник в области псевдодиафрагмы и ануса, извлекают комплекс внутренних органов. Осторожно отделяют желудок, кишечник, печень с желчным пузырем и селезенку.
После отделения плавательного пузыря обнажают почки, лежащие вдоль позвоночника в виде ленты темно-красного цвета.
При осмотре плавательного пузыря определяют его форму, толщину и прозрачность оболочек, наличие кровоизлияний, пятен ге- мосидерина, экссудата в полости и т. д.
Состояние паренхиматозных органов (печени, почек, селезенки) оценивают по внешним признакам: размеру, консистенции, цвету, кровенаполнению, наличию кровоизлияний, очагов некроза, рисунку на разрезе и др. Кишечник разрезают вдоль, промывают в воде, просматривают состояние слизистой, учитывают количество гельминтов и др.
При осмотре сердца отмечают его размер, форму, состояние миокарда, степень наполнения полостей кровью и ее свертываемости, наличие сгустков, кровоизлияний.
Вскрывают черепную коробку с помощью четырех разрезов, из которых первым поперечным разрезом отсекают крышку у носо-
|
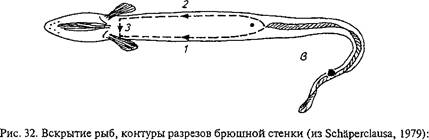 а — карпа и других карповых; б — форели и лососевых; в — угря
а — карпа и других карповых; б — форели и лососевых; в — угря
|
вых ямок; два боковых разреза проходят от носовых ямок до затылочной области, а четвертый — в области затылка. Сначала проводят внешний осмотр оболочки головного мозга, затем его извлекают и характеризуют состояние вещества мозга, его кровенаполнение и др.
При осмотре скелетной мускулатуры обращают внимание на цвет, консистенцию, наличие кровоизлияний, отека, припухлостей, цист паразитов, степень прикрепления к костям.
Патологоанатомические изменения сопоставляют с клиническими симптомами, выявляют характерный комплекс признаков основного заболевания и сопутствующие осложнения (болезни), а также используют их для определения главной и непосредственной причины гибели рыб. В сомнительных случаях данные вскрытия уточняют с помощью гистологического исследования патматериала.
Обработку патматериала проводят общими методами гистологической техники. По нашему опыту, кусочки органов рыб лучше заливать в целлоидин-парафин, а жабры, кожу и плавательный пузырь — в целлоидин. Срезы окрашивают общепринятыми методами.
ПРАВИЛА ОТБОРА И ПЕРЕСЫЛКИ МАТЕРИАЛОВ ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Пробы воды берут в нескольких точках водоема с таким расчетом, чтобы собранные образцы отражали гидрохимическое состояние водоема или загрязненность его отдельного участка (зоны гибели рыб, места впадения ручья или сбросного канала, района интенсивного поверхностного стока и т.д.), а также в незагрязненном участке (выше по течению). В прудах и других проточных емкостях берут пробы на вытоке воды.
Пробы воды (не менее 2 л) отбирают батометром из поверхностных (на глубине 50 см) и придонных слоев в чистые стеклянные или полиэтиленовые бутылки (см. рис. 20). Перед заполнением посуду ополаскивают 2—3 раза исследуемой водой. В тех случаях, когда время транспортирования пробы составляет более 1 сут, их рекомендуется фиксировать различными консервантами в зависимости от целей исследования. Зимой воду при транспортировании следует утеплять, чтобы исключить ее замерзание.
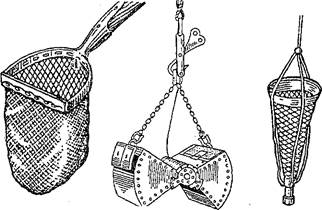
Пробы грунта (массой 2 кг) берут также из разных зон водоема дночерпателем Экмана или Кирпичникова. Грунт сушат, на воздухе и упаковывают в широкогорлые банки или полиэтиленовые мешки (рис. 33).
Бентосные организмы (хирономиды, олигохеты, моллюски) в количестве 100—150 г отмывают от ила водой из водоема.
|
| А Б |
| В |
| Рис. 33. Приспособления для взятия проб грунта и планктона: А — скребок; Б — дночерпатель; В — планктонная сетка |
Планктон собирают планктонной сеткой, фильтруя такое количество воды, которое необходимо для получения около 50 г живой массы планктона.
Больных или подозрительных по заболеванию рыб доставляют в ветеринарную лабораторию живыми. Для исследования берут 10— 15 рыб на различных стадиях болезни.
Живых рыб перевозят в молочных бидонах или других емкостях, заполненных на 3/4 объема водой из того же водоема, откуда взята проба, или водой из артезианской скважины.
Летом при длительном транспортировании воду с рыбой постепенно охлаждают до температуры 12—15 °С, добавляя мелкие кусочки льда. Чтобы не вызывать у рыб температурного шока, нельзя допускать перепад температуры воды исходного водоема и транспортной емкости более 5—7 °С.
В случае невозможности выполнить эти условия отбирают патматериалы от больных рыб и соответствующим способом консервируют. Для химико-токсикологического анализа пригодны снулая рыба или свежие трупы, которые отправляют в охлажденном, замороженном виде или консервируют 70°-ным спиртом.
Кусочки органов для бактериологических и вирусологических исследований отбирают стерильно, замораживают или консервируют 40—50%-ным раствором глицерина в кипяченой воде или физиологическом растворе. Кровь, экссудат и другой жидкий пат- материал доставляют в запаянных пастеровских пипетках. Пробы для микологических исследований консервируют в растворе антибиотиков (пенициллина или стрептомицина по 100 ЕД/мл раствора). В исключительных случаях делают посевы в лаборатории рыбоводного хозяйства.
Кровь для исследований берут пастеровской пипеткой из хвостовых сосудов (артемии и вены) или из сердца с соблюдением правил асептики и антисептики (рис. 34). Взятую кровь используют для посева, приготовления мазков, гематологических и биохимических исследований. Цельную кровь стабилизируют гепарином (1000 ЕД/мл) или лимоннокислым натрием. Сыворотку крови получают общепринятым методом, помещают в стерильные запаянные ампулы, а летом консервируют 5%-ным раствором фенола (1—2 капли на 1 мл сыворотки) или тиомерсалом из расчета 10 мг препарата на 10 мл сыворотки. Отобранные жидкие материалы перевозят в термосе со льдом.
|
Материал для гистологических исследований берут от погибших и вынужденно убитых рыб. Мелких рыб (мальки и се-
Рис. 34. Места взятия крови из хвостовых сосудов карпа:
1 — у сеголетков; 2— у карпов старшего возраста
голетки) после вскрытия брюшной полости фиксируют целиком, а от крупных особей берут органы или кусочки органов размером 2 х 3 см и толщиной 0,5—1,0 см. Кусочки из пораженных органов и тканей вырезают так, чтобы были захвачены нормальные и измененные участки. Независимо от степени поражения берут кусочки кожи с подлежащей мускулатурой, жабр, печени, почек, селезенки, сердца, кишечника, плавательного пузыря, головного мозга. Кишечник перед фиксацией осторожно вскрывают или делают на нем несколько надрезов, чтобы фиксирующая жидкость проникла в его полость. Головной мозг осторожно извлекают целиком после вскрытия черепной коробки. Подлежащий исследованию материал помещают в стеклянные банки и фиксируют 10%-ным нейтральным формалином, жидкостью Буэна или Карнуа.
С пораженных органов собирают паразитов и консервируют разными способами в зависимости от их систематического положения и размеров. Для определения простейших — инфузорий, жгутиконосцев — готовят мазки соскобов из жабр и кожных покровов на предметных стеклах, подсушивают их на воздухе и хранят в бумаге или фиксируют жидкостью Шаудина 15—20 мин. Из цист миксо- споридий также готовят мазки на предметных стеклах, которые сразу заключают в глицерин-желатину.
Гельминтов собирают с органов в солонки или чашки Петри, промывают от слизи водой или физиологическим раствором и выдерживают в них до гибели паразита. Моногенетических сосальщиков сразу заключают в глицерин-желатину на предметных стеклах или фиксируют в 4%-ном растворе формалина. Трематод, ленточных червей и скребней фиксируют 70°-ным спиртом между стеклами так, чтобы они расправились, а у скребней вышел хоботок; нематод и личинок цестод консервируют в жидкости Барбагалло. Паразитических рачков фиксируют в 70°-ном спирте или 4%-ном формалине, пиявок —в 4%-ном формалине, не раздавливая, и глохидий — в 70°-ном спирте.
Отобранные материалы подробно описывают, этикетируют, упаковывают в водонепроницаемую тару, опечатывают и высылают с нарочным в ветеринарную лабораторию или другое учреждение, где имеются возможности для исследования. В сопроводительном письме сообщают данные обследования водоема, указывают предполагаемый диагноз и какие лабораторные исследования необходимо провести.
БАКТЕРИОЛОГИЧЕСКИЕ И ВИРУСОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Для доказательства бактериальной или вирусной этиологии болезней рыб необходимо выделить возбудителя из организма больных рыб, идентифицировать его по культурально-морфологичес- ким, антигенным и биологическим признакам, воспроизвести болезнь на здоровых рыбах, повторно выделить (реизолировать) возбудителя от экспериментальных животных. Все эти исследования
проводят по общепринятой схеме с учетом особенностей организма рыб и возбудителей болезней (схема I, табл. 11).
Схема I. Лабораторная диагностика бактериальных болезней рыб Патологический материал от больных рыб
f ^
Посевы на МПБ, МПА, Микроскопия мазков кро-
дифференциальные среды ви и отпечатков органов
^ ---------------------------------------- ---------
Выращивание пер- I Окраска по Граму, окраска Миксобактерии, мико-
вичных культур г>- на оксидазу, определение бактерии и др.
(/ = 24...26 °С) I подвижности
Чистые культуры сем. Vibriomceae и др.
| ности |
i t I. Изучение биохимичес- II. Определение патоген-
ких свойств
III. Изучение антигенных свойств
1. Среды Гисса
2. Среда Хью-Лейфсона
3. Протеолитическая активность и др.
вида
2. Клинические признаки
3. Реизоляция возбудителя
смесью сывороток
2. Капельная РА с моновалентной сывороткой
| 1. Заражение рыб того же I. Капельная РА со |
3. Пробирочная РА с моновалентной сывороткой
Бактериологические посевы проводят вначале с пораженных участков кожи, мышц (язвы, абсцессы и др.), жаберной ткани, крови и асцитной жидкости, а после вскрытия полости — обязательно с печени, почек или селезенки. Материал для вирусологических исследований отбирают из органов и тканей, где концентрируется вирус, а при малоизученных болезнях — из наиболее пораженных органов.
Язвы перед отбором патологического материала промывают стерильным физиологическим раствором; содержимое абсцессов, фурункулов, асцитной жидкости набирают пастеровской пипеткой после прижигания места прокола.
Для асептического вскрытия рыбу обездвиживают, фиксируют препаровальными иглами на деревянной или пробковой доске. Туловище с левой стороны освобождают от слизи и чешуи, удаляют грудной и брюшной плавники, дезинфицируют 70°-ным спиртом или фламбируют спиртовым тампоном. Брюшную стенку отсекают стерильными ножницами полулунным разрезом от ануса к жаберной крышке. Патматериал с паренхиматозных органов отбирают стерильно пастеровскими пипетками или бактериологической петлей.
Первичные бактериологические посевы проводят на МПБ, МПА и некоторые дифференциальные среды (например, кровяной агар, Китт—-Тароцци). Патологический материал для вирусологи-
11. Основные свойства бактерий сем. Vlbrionaceae
|
| Aeromonas hydrophila |
V. hydrophila + + + + кг кг — кг кг +
A. hydrophila, v. anaerogenes + + + + к к — к к +
V. salmonicida — + + + кг кг — — кг —
Pseudomonas fluorescens + + + — — — — к к ±
Ps. cyprinisepticum ++ + — __ ___ +
Ps. putida + + + — — к к к ± к +
Ps. capsulata + + + ______ +
Vibrio anguillarum + + + + к к — + к —
Обозначения: О — окисление; Ф — ферментация; (+) — положительная реакция, наличие признака; (—) — отрицательная реакция, отсутствие признака; ± — сомнительный результат; к — образование кислоты; кг — образование кислоты и газа.
ческих исследований засевают на первичные однослойные или перевиваемые клеточные культуры, полученные из органов и тканей рыб. В нашей стране выращивают в основном две клеточные линии: ЕРС, полученную из эпителия оспенных разростов карпа, и FHM, полученную из кожно-мышечной ткани рыбы пимефала. Посевы бактерий и вирусов инкубируют в термостате при температуре 24—26 °С.
Для ускоренной дифференциации псевдомонад и аэромонад от сходных с ними родов бактерий определяют оксидазную активность культур и способность их расщеплять глюкозу на среде Хыо- Лейфсона (тест окисления — ферментации).
Одновременно или после окончания посевов готовят мазки крови и отпечатки из некротических участков, язв, паренхиматозных органов, трассудата или экссудата. Их окрашивают по Романовскому—Гимза или по Граму общепринятыми способами.
МИКОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
При подозрении на грибковые заболевания рыб проводят микологические, а при бранхиомикозе и глубоких микозах -— гистологические исследования.
При большинстве микозов рыб (бранхиомикоз, сапролегниоз и др.) достаточно надежным методом диагностики является микроскопическое исследование патологического материала. Исследуют нативные препараты из пораженных органов с добавлением нескольких капель 50%-ного водного раствора глицерина, 0,9%-ного раствора хлорида натрия или водопроводной воды.
При исследовании на бранхиомикоз микроскопируют некроти- зированные участки или подвергнутые гнилостному разложению жабры больных рыб. Соскобы с жабр помещают на предметное стекло, добавляют несколько капель воды или других растворов, раздавливают покровным стеклом и просматривают при малом и среднем увеличении. В поле зрения микроскопа хорошо видны гифы гриба со спорами. В гистологических срезах они располагаются в просвете сосудов и респираторных складках, окрашиваются гематоксилин-эозином в темно-лиловый цвет.
Для обнаружения сапролегниевых грибов исследуют под микроскопом соскобы с кожи, жабр, носовых ямок, а также икру. При этом хорошо видны гифы гриба, заканчивающиеся зооспоран- гиями.
При глубоких микозах (ихтиофонозе, экзофиаламикозе, мико- тическом грануломатозе) исследуют микроскопически нативные раздавленные препараты из пораженных органов (печени, почек, селезенки и др.).
Чистые культуры грибов выделяют на обычных грибных средах — агаре Сабуро, Чапека, МПА. Для выделения возбудителя бранхиомикоза посевы делают из жабр, подвергшихся гнилостному разложению. Возбудителей ихтиофоноза и других глубоких микозов культивируют на МПА с добавлением 1 % сыворотки крупного рогатого скота, а также на глюкозо-дрожжевом агаре.
Сапролегниевые грибы хорошо растут на стерилизованных кипячением семенах конопли и льна, помещенных в агаровые пластины (1,5%-ный агар на воде), которые раскладывают в чашках Петри. Грибок растет при комнатной температуре в виде ватообразных колоний. Его также культивируют на МПА, агаре Чапека и Сабуро, для чего вырезают из них небольшие блоки, засевают культурой и раскладывают в чашки Петри.
ПОСТАНОВКА БИОЛОГИЧЕСКИХ ПРОБ
В ряде случае для установления окончательного диагноза на инфекционную болезнь, а также при решении вопроса о снятии карантина или карантинных ограничений с хозяйства ставят биологические пробы. При постановке их с целью определения патогеннос- ти возбудителей используют чистые культуры бактерий, вирусов, грибов. Кроме того, применяют нативные суспензии и взвеси, приготовленные из различных органов и тканей больных или подозреваемых в заражении рыб.
Биопробы ставят в аквариумах, ваннах или бассейнах, создавая в них оптимальные условия для жизни рыб и размножения возбудителей. Наблюдения ведут ежедневно, учитывают число погибших рыб, клинические признаки болезни и характер патологоанатоми- ческих изменений. Продолжительность опытов устанавливают с учетом инкубационного периода и длительности течения заболевания в естественных условиях. В опыты отбирают восприимчивых к данному заболеванию рыб из благополучного хозяйства. В каждой серии для заражения и контроля берут по 10 рыб.
При вирусных болезнях в качестве инфекционного материала берут свежеприготовленную вируссодержащую суспензию культуры клеток или безбактериальные фильтраты суспензий органов больных рыб. Количество вируссодержащего материала и способ заражения подбирают индивидуально для каждого заболевания. Материал вводят внутрибрюшинно, контактным методом, орошением жабр или выдерживанием рыб в воде, содержащей вирус. Параллельно ставят контрольные опыты.
Для подтверждения бактериальной природы болезни испытывают чистые культуры. Здоровых рыб заражают 2-суточными бульонными культурами внутрибрюшинно или внутримышечно в дозах 0,1—0,2 мл (рис. 35). Молодые или старые культуры для биопробы непригодны, так как у них меняются вирулентные свойства. Музейные штаммы перед опытом пассируют через восприимчивых рыб.
Для ускорения исследований предварительно патогенность определяют по ДНК-азной активности выделенных культур.
При постановке биологической пробы для диагностики микозов используют нативный материал, в котором содержится возбу-
Рис. 35. Внутрибрюшинное заражение рыб и введение лекарственных препаратов:

|
а — фиксация рыб; б — место инъекций
дитель на всех стадиях развития, или выращивают патогенные грибы на специальных питательных средах до стадий, пригодных для заражения. Дозу вводимого патологического материала в каждом конкретном случае определяют титрованием на восприимчивых рыбах.
Биологическая проба считается положительной, если у 80 % зараженных рыб проявляется комплекс клинических признаков и патологоанатомических изменений болезни и погибает не менее 50 % заболевших рыб при полном сохранении их в контроле, а также при выделении исходных возбудителей. 1
По окончании опытов воду в аквариумах обеззараживают, создавая в ней 4%-ную концентрацию формалина или 10%-ную концентрацию суспензии хлорной извести. Через 1 ч воду спускают в канализационную сеть, а рыб утилизируют. Весь инвентарь и посуду, бывшие в контакте с больной рыбой, дезинфицируют в 4%-ном растворе формальдегида в течение 1 ч.
При завершении биологической пробы в бетонированных бассейнах, земляных садках, карантинных прудах проводят дезинфекцию воды хлорированием, доводя содержание свободного хлора в воде до 4—5 мг/л. Через 24 ч воду пропускают через известковый фильтр (используя только свежую негашеную известь). После этого ложе прудов дезинфицируют негашеной (10 т/га) или хлорной известью (3 т/га) и оставляют без воды в течение 1 мес.
В случае, если ставится вопрос о снятии карантина или других ограничений, биопробу проводят непосредственно в прудах хозяйства согласно инструкции по борьбе с соответствующим заболеванием.
ГЕМАТОЛОГИЧЕСКИЕ И БИОХИМИЧЕСКИЕ ИССЛЕДОВАНИЯ

|
Кровь рыб четко реагирует на воздействие различных патогенных факторов: неблагоприятных условий среды, токсикантов, возбудителей заразных болезней и т. д. По изменениям крови можно судить о характере патологических процессов, происходящих в организме рыб. Результаты гематологических и биохимических исследований крови относятся к дополнительным и позволяют уточнить диагноз болезни.
Основными гематологическими показателями, используемыми при диагностике болезней рыб, являются: определение количества эритроцитов и лейкоцитов, уровня гемоглобина, скорости оседания эритроцитов (СОЭ) и выведение лейкограммы. Из биохимических показателей наиболее часто определяют содержание в крови сахара, общего белка и его фракций, активность основных ферментов (каталазы, пероксидазы, ацетилхолинэстеразы и многих других).
Для исследования крови рыб применяют те же методики, что и для теплокровных животных, с учетом ряда особенностей, связанных с клеточным составом, физико-химическими свойствами крови рыб и др. Активность ферментов рыб определяют при температуре 24—26 °С.
Кровь у рыб берут из хвостовых сосудов (артерии и вены) или из сердца с помощью пастеровских пипеток или шприца с максимально толстой иглой. Предварительно их орошают раствором гепарина или лимоннокислого натрия (цитрата натрия).
Дата добавления: 2016-06-24; просмотров: 1090;
