ОСНОВНІ ТЕРМОДИНАМІЧНІ ПОНЯТТЯ Й ВИЗНАЧЕННЯ
ЗАВДАННЯ Й РОЗДІЛИ ФІЗИЧНОЇ ХІМІЇ
Фізична хімія – розділ хімії, у якому вивчається взаємозв'язок хімічних процесів і фізичних явищ, які їх супроводжують, установлюється зв'язок між хімічним складом, будовою речовин і їхніх властивостей, досліджуються механізм і швидкість хімічних реакцій залежно від умов їхнього протікання.
Зміст курсу фізичної хімії звичайно ділять на кілька основних розділів, що характеризують напрямок цієї науки й визначають її предмет. Розглянемо основні її розділи:
— хімічна термодинаміка – вивчає зв'язок між теплотою й роботою, і властивостями речовин або систем. Вивчає макроскопічні властивості тіл і їхньої зміни при обміні тіл або систем енергією або речовиною. Вивчає властивості систем незалежно від простору й часу, її не цікавить швидкість, і шлях протікання хімічних реакцій. У свою чергу хімічна термодинаміка включає термохімію, у якій вивчаються теплові ефекти хімічних реакцій.
— вчення про розчини – розглядає природу розчинів, їхню внутрішню структуру й найважливіші властивості.
— електрохімія – вивчає особливості властивостей розчинів електролітів, електропровідність розчинів, процеси електролізу, роботу гальванічних елементів і електрохімічну корозію металів.
— хімічна кінетика – вивчає швидкість і молекулярний механізм хімічних реакцій як у гомогенної, так і в гетерогенному середовищі, включаючи і явища каталізу.
ОСНОВНІ ТЕРМОДИНАМІЧНІ ПОНЯТТЯ Й ВИЗНАЧЕННЯ
Система– тіло або група тіл, реально або подумки виділених з навколишнього середовища.
Термодинамічна система– група взаємодіючих тіл системи, між якими відбувається обмін теплотою або речовиною, або вона описується термодинамічними параметрами.
Навколишнє середовище – усе, що перебуває в контакті із системою.
У хімічній термодинаміці виділяють кілька типів систем по їхній здатності взаємодіяти із зовнішнім середовищем:
— відкрита – система, що обмінюється з навколишнім середовищем речовиною й енергією;
— закрита – система, що обмінюється з навколишнім середовищем тільки енергією й роботою, але не речовиною;
— ізольована – система не обмінюється з навколишнім середовищем ні речовиною, ні енергією.
Стан системи – сукупність всіх фізичних і хімічних властивостей системи.
Термодинамічні параметри стану системи –фізичні характеристики термодинамічної системи. Розрізняють:
1. Екстенсивні властивості, що залежать від маси системи (V, m, U, H і т.д.) і характеризуються адитивністю, тобто властивість системи дорівнює сумі відповідних властивостей її складових частин:
властивість системи = ∑ властивостей частин.
2. Інтенсивні властивості, що не залежать від маси системи (T, p, m, r і т.д.). Ці властивості не підсумуються, а вирівнюються.
Основні параметри стану – параметри, що піддаються прямому виміру. Ті параметри, які не можна виміряти безпосередньо, розглядають як функції основних параметрів стану.
Функція стану – зміна її визначається тільки вихідним і кінцевим станом системи й не залежить від шляхів переходу.
Зміна стану системи, що характеризується зміною її термодинамічних параметрів, називається термодинамічним процесом.
Зміна стану системи може відбуватися при різних умовах, тому розрізняють:
1) Рівноважні й нерівноважні процеси. Рівноважні процеси розглядаються як безперервний ряд рівноважних станів системи. Рівноважний стан системи – стан, що не змінюється в часі й не потребуюче для своєї підтримки яких-небудь зовнішніх факторів. Нерівновжані - це процеси, після протікання яких систему не можна повернути у вихідний стан без того,щоб у ній не залишилося яких-небудь змін.
2) Оборотні й необоротні процеси. Оборотні - процеси, що допускають можливість повернення системи в первісний стан без того, щоб у навколишнім середовищі залишилися які-небудь зміни. У противному випадку процеси будуть необоротними.
3) Самодовільні й не самодовільні процеси. Самодовільні - процеси, що відбуваються самі собою (не потребуючі витрати енергії ззовні) і наближающих систему до рівноваги. Не самодовільні - процеси, що вимагають витрати енергії ззовні.
Відзначимо деякі приватні види процесів, з якими надалі прийде мати справа:
а) ізотермічний (T = const);
б) ізобарний (p = const);
в) ізохорний (V = const);
г) адіабатичний (немає обміну теплотою між системою й навколишнім середовищем);
д) ізобарно – ізотермічний (p = const, T = const);
е) ізохорно – ізотермічний (V = const, T = const).
Розглянемо ще деякі поняття.
Енергія – міра здатності системи робити роботу.
Внутрішня енергія – весь запас внутрішньої кінетичної й потенційної енергії речовини без кінетичної й потенційної енергії всієї системи. Внутрішня енергія позначається символом U. Абсолютне значення внутрішньої енергії визначити неможливо навіть для найпростіших систем. Однак для цілей термодинаміки цього й не потрібно. Важливо кількісно визначити зміна внутрішньої енергії при переході з одного стану в інше:
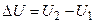 . (1)
. (1)
Величина внутрішньої енергії системи вважається позитивної, якщо в розглянутому процесі вона збільшується. У рівноважному стані система має певний запас енергії, тому внутрішня енергія є функцією стану.
Роботай теплота – дві можливі форми передачі енергії від однієї системи до іншої. Робота – це енергія, передана одним тілом іншому, що не залежить від температури тіл і не пов'язана з переносом маси.
Робота позначається символом A, при цьому робота позитивна (А > 0), якщо вона відбувається системою проти зовнішніх сил, і негативна (А < 0), якщо вона виконується над системою. У хімічній термодинаміці найчастіше розглядають роботу розширення. Якщо розглядати роботу розширення А, чинену системою, то рівноважному процесу завжди відповідає максимальна робота.
Теплота– енергія, передана одним тілом іншому, що залежить від температури тіл і не пов'язана з переносом маси. Теплота позначається символом Q, при цьому вона позитивна (Q > 0), якщо теплота надходить у систему (такий процес називається ендотермічним), і негативна (Q < 0), якщо теплота приділяється із системи (такий процес називається екзотермічним).
У рівноважному стані система не володіє ні запасом теплоти, ні запасом роботи, тому вони є функціями процесу. Передача теплоти або здійснення роботи здійснюються лише при взаємодії системи із зовнішнім середовищем або іншою системою.
Дата добавления: 2016-06-02; просмотров: 633;
