ЗАКОНЫ ГЕЙ-ЛЮССАКА И ШАРЛЯ.
ШКАЛА Кельвина
Французский ученый Гей-Люссак экспериментально установил, что если газ нагревать при постоянном давлении, то его объем будет увеличиваться. Причем зависимость объема от температуры имеет вид
V(t) = V0(1 + at), (3.1)
где V0 – объем данной массы газа при t = 0 °С; V(t) – объем данной массы газа при температуре t; a – температурный коэффициент объемного расширения газа.
Как видим, зависимость точно такая же, как и для твердых тел и жидкостей. Но вот что удивительно: если каждая жидкость и каждое твердое тело имеют свой коэффициент объемного расширения, то для всех газов коэффициент объемного расширения один и тот же:
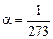 1/°С.
1/°С.
Процесс, происходящий при постоянном давлении называетсяизобарическим (от греческих слов isos – равный и baros – тяжесть, вес).
Зависимость объема газа от температуры при его нагревании при постоянном давлении называется изобарой. Эта зависимость на графике изображается прямой линией (рис. 3.1).
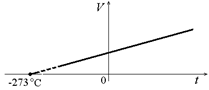 Рис. 3.1
Рис. 3.1
Идеальный газ
Если продолжить изобару в область низких температур, где измерения не проводились, то прямая пересечет ось температуры в точке, соответствующей объему, равному нулю (пунктирная прямая на рис. 3.1). Но это не означает, что объем газа действительно обращается в нуль. Ведь все газы при сильном охлаждении превращаются в жидкости, а к жидкостям ни закон Гей-Люссака, ни закон Бойля–Мариотта неприменимы.
Реальные газы подчиняются основным газовым законам лишь приближенно и тем менее точно, чем больше плотность газа и ниже его температура. Газ, который в точности подчиняется газовым законам, называютидеальным.
При увеличении температуры объем газа неограниченно возрастает. Не существует никакого предела для роста температуры1. Напротив, низкие температуры имеют предел.
Согласно закону Гей-Люссака (3.1) при понижении температуры объем стремится к нулю. Так как объем не может быть отрицательным, то температура не может быть меньше определенного значения (отрицательного по шкале Цельсия).
Дата добавления: 2016-04-11; просмотров: 1170;
