Нервно-мышечный синапс в норме и патологии
Возбуждение аксона передается на мышцу через нервно-мышечный синапс, который образуется 1)окончанием двигательного аксона – терминалью аксона, 2)синаптической щелью и 3)постсинаптической мембраной – мышечной концевой пластинкой. Терминаль аксона не имеет миелиновой оболочки, так как перед образованием терминалей аксон теряет миелиновое покрытие. Однако Шванновские клетки покрывают терминали аксона и отграничивают их от окружающей ткани (рис. 16).
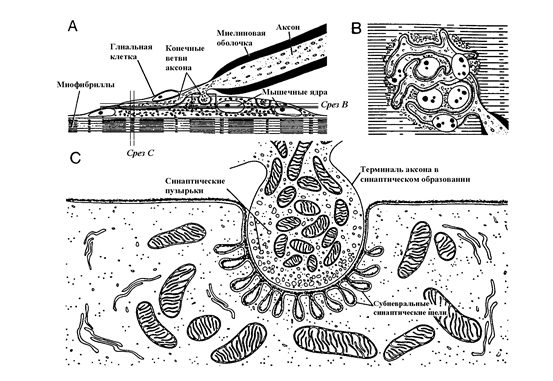
Рис. 16. Микроскопическая картина нервно-мышечного синапса
(По W.Bloom and D.W.Faecett, 1975).
A – срез концевой пластинки вдоль аксона,
B – вид сверху,
C – электронная микроскопия при поперечном срезе.
Каждая терминаль аксона образует синапс с одним мышечным волокном. Синапс расположен в центральной части мышечного волокна. В месте соединения терминали аксона и мышечного волокна в мышечной концевой пластинке имеется углубление, которое называется синаптической канавкой, или первичной синаптической щелью. Постсинаптическая мембрана имеет складчатую структуру, пространство между складками образует вторичную синаптическую (субневральную) щель. За счет складчатой структуры постсинаптическая мембрана в 10 раз длиннее пресинаптической. На вершинах складок расположены ацетилхолиновые рецепторы, которые воспринимают порции ацетилхолина, выделяющиеся из пресинаптической мембраны. Пресинаптическая терминаль содержит митохондрии, ацетилхолин и 2 фермента: ацетилтрансферазу, синтезирующую ацетилхолин, и холинэстеразу, расщепляющую ацетилхолин. Эти элементы содержатся не только в терминалях аксона, но и в проксимальных отделах аксона, что свидетельствует о синтезе ацетихолина в теле мотонейрона и последующей транспортировке его к терминалям. В случае повреждения аксона этот транспорт прекращается, и мышечное волокно оказывается в условиях денервации. Ацетилхолин в терминалях аксона содержится в везикулах, количество которых насчитывает до 10.000, причем из них 1000 находится непосредственно у пресинаптической мембраны (оперативный запас), готовых к выделению в синаптическую щель, остальная часть является мобильным запасом, готовым к быстрому перемещению к мембране взамен освобождающегося медиатора. Наиболее существенен стационарный резерв (около 300.000 везикул), он находится в более проксимальных отделах терминали. Освобождение медиатора в синаптическую щель происходит порциями. Минимальная порция – везикула медиатора, которая содержит около 5.000 – 10.000 молекул ацетилхолина и называется квантом. Передача информации от нерва к мышце происходит квантами. Так как количество молекул медиатора в кванте постоянно, то степень взаимодействия определяется только частотой и количеством выделяемых квантов. В состоянии покоя мышцы при отсутствии раздражения нерва имеет место фоновое выделение квантов медиатора. Часть молекул кванта медиатора, попадая в синаптическую щель, сразу подвергаются разрушающему воздействию холинэстеразы. Благодаря незначительной ширине синаптической щели оставшаяся часть молекул ацетилхолина (около 50-60%) соединяется с холинорецепторами. В результате взаимодействия одного кванта ацетилхолина с постсинаптической мембраной генерируется миниатюрный потенциал концевой пластинки, величина которого составляет около 1 мВ. При возникновении миниатюрного потенциала концевой пластинки потенциал покоя мембраны мышцы изменяется незначительно. Для активации мембраны в норме выделяется значительное количество квантов (в 100 раз превышающее необходимое для развития возбуждения), которые генерируют несколько сотен миниатюрных потенциалов концевых пластинок. Суммируясь, миниатюрные потенциалы концевой пластинки формируют потенциал концевой пластинки. Потенциал концевой пластинки изменяется постепенно (градуально) пока не достигнет критического уровня деполяризации. При достижении критического уровня деполяризации генерируется потенциал действия, который распространяется по мембране и вызывает сокращение мышечного волокна.
При патологии нервно-мышечной передачи нарушения проведения во многом обусловлены интимными механизмами синтеза ацетилхолина, транспортировки его из резервов к пресинаптической мембране и высвобождения в синаптическую щель. В реализации любого патологического механизма нервно-мышечной передачи (уменьшение выделения ацетилхолина, понижение чувствительности постсинаптической мембраны) снижение как сократительной возможности мышцы, так и амплитуды М-ответа обусловлено тем, что транссинаптическая активация способна активировать только часть мышечных волокон из общего числа имеющихся в мышце. В части мышечных волокон потенциал концевой пластинки оказывается недостаточным для генерации потенциала действия и, несмотря на 100% возбуждение мотонейронов и 100% возбуждение двигательных единиц, не все мышечные волокна в двигательных единицах оказываются активированными.
При миастении и миастеническом синдроме возникают морфологические изменения (рис. 17) выражающиеся в том, что при миастении значительно атрофируются элементы постсинаптической мембраны, а при миастеническом синдроме они гипертрофируются.
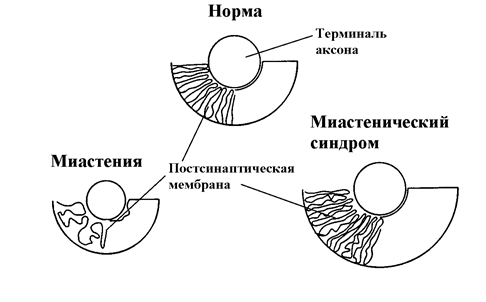
Рис. 17. Схематическое представление морфологических изменений при миастении
и миастеническом синдроме (По A.G.Engel and T.Santa, 1971).
Хотя в последнее время показано, что патологические механизмы при нарушении нервно-мышечной передачи не столь просты и однозначны, для формализации представлений предлагаемые описания оправданы. Нарушения функционирования нервно-мышечного соединения при различной патологии наглядно демонстрируются в условиях активации всех двигательных единиц мышцы – максимальной нагрузки.
В норме однократная активация мотонейронов приводит к выделению медиатора из оперативного резерва с многократным превышением достаточного уровня. Дефицит квантов медиатора в оперативном резерве восполняется из мобильного резерва. Для освобождения медиатора из везикулы необходимо участие ионов кальция, которые в период возбуждения терминали аксона входят в нейрон. После активации мотонейрона и выделения медиатора необходимо 100-200 мс на удаление кальция из клетки. Непосредственный выброс медиатора в синаптическую щель происходит после соединения мембраны везикулы с мембраной терминали аксона, которое регулируется протеином синаптической везикулы – синаптобревином и двумя белками терминали аксона – синтаксином и SNAP-25. При низкочастотной стимуляции нерва супрамаксимальными стимулами 3 Гц (межимпульсный интервал 333 мс) расходуемый медиатор в оперативном резерве успевает пополняться из мобильного резерва, однако количество квантов медиатора снижается и понижается надежность нервно-мышечной передачи. Ионы кальция успевают выводиться из терминали аксона после каждого стимула. При высокочастотной тетанической стимуляции 30-50 Гц (межстимульный интервал 33-20 мс) или при максимальном произвольном усилии 10-15 секунд дефицит медиатора пополняется из стационарного резерва. Для транспортировки медиатора из стационарного резерва требуется 10 мс. Кроме того, высокая частота стимуляции (выше 5 Гц) препятствует полному удалению кальция, и он накапливается в терминали аксона, способствуя более значительному освобождению медиатора, и обусловливает посттетаническое облегчение. Однако, несмотря на изменения в количестве выделяемых квантов медиатора, в норме его достаточно для возбуждения всех мышечных волокон, поэтому М-ответ не может ни уменьшиться, ни увеличиться по амплитуде. Низкочастотная (3 Гц) стимуляция является тестом на оценку механизмов высвобождения и оперативной мобилизации медиатора, а высокочастотная (50 Гц) стимуляция – на оценку механизмов ресинтеза и мобилизации медиатора из стационарного депо (табл. 2).
Таблица 2
Физиологические механизмы, лежащие в основе тестовых нагрузок
при оценке нервно-мышечной передачи
| Физиологические механизмы | 3 Гц стимуляция | 50 Гц стимуляция |
| Активация синтез медиатора | – | + |
| Мобилизация медиатора из стационарного резерва | – | + |
| Мобилизация медиатора из мобильного резерва | + | + |
| Накопление ионов кальция и усиление выделения медиатора в синаптическую щель | – | + |
| Выделение в синаптическую щель медиатора | + | +++ |
| Взаимодействие медиатора с холинорецепторами | + | ++ |
| Повышение синхронизации потенциалов действия мышечных волокон | – | + |
При миастении синтез и транспорт медиатора в терминали аксона страдает незначительно, но в связи с понижением чувствительности постсинаптической мембраны, выделяющийся медиатор не способен активировать достаточное количество мышечных волокон и большей частью разрушается холинэстеразой до взаимодействия с холинорецептором. Вследствие аутоиммунного процесса ацетилхолинорецепторы оказываются заблокированными комплексами. В связи с этим высоконадежные механизмы синтеза, транспортировки ацетилхолина, имеющиеся в норме, оказываются недостаточными, и особенности этих механизмов определяют суть патологических проявлений. В зависимости от степени выраженности клинических проявлений при миастении, несмотря на мобилизацию всех мотонейронов, активируются не все мышечные волокна за счет невозможности взаимодействия медиатора с неактивной частью рецепторов. Это обусловливает незначительное снижение амплитуда М-ответа. В легких случаях активируются все мышечные волокна, но без дополнительной степени надежности, М-ответ имеет нормальную амплитуду. Ритмическая низкочастотная стимуляция (3 Гц), снижая надежность синапса в условиях понижения чувствительности холинорецепторов, вызывает дефицит в активации постсинаптической мембраны части мышечных волокон. В результате этого следующие после первого мышечные ответы имеют снижающуюся амплитуду (феномен декремента) (рис. 18).
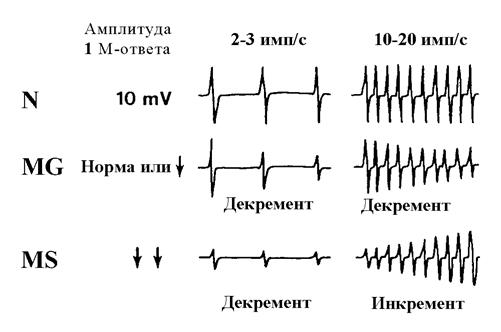
Рис. 18. Феномены нервно-мышечной передачи при ритмической стимуляции
в норме, при миастении и миастеническом синдроме (По J.Kimura, 1978).
N – норма,
MG – миастения,
MS – миастенический синдром.
Ионы кальция между стимулами успевают выводиться, и дополнительного выброса медиатора в синаптическую щель не происходит. При высокочастотной стимуляции (50 Гц) не происходит достаточного синтеза и восполнения расходуемого медиатора из стационарного депо. Вследствие этого, несмотря даже на повышение в терминалях аксона ионов кальция за счет задержки их выведения, количество медиатора, выделяемого в синаптическую щель, уменьшается, приводя к усилению феномена декремента. Однако после тетанической активации значительно восполненный дефицит ацетилхолина при наличии неполностью выведенного кальция приводит к повышению выделения медиатора и уменьшению проявления декремента при посттетанической 3 Гц стимуляции (феномен облегчения) (рис.19). Это состояние длится 10-15 секунд, а затем возникает истощение за счет выведения ионов кальция из цитоплазмы нейрона. Состояние истощения длится 2-10 минут. Снижение фактора надежности нервно-мышечной передачи при функциональной нагрузке и при проведении диагностических тестов является критичным при миастении вследствие «заблокированности» холинорецепторов. Подтверждением основной роли постсинаптической мембраны в механизмах нервно-мышечной передачи при миастении является факт улучшения синаптической проводимости при использовании антихолинэстеразных средств: прозерина, тензилона.
Миастенический синдром (синдром Ламберта-Итона) имеет принципиально другой механизм нарушения нервно-мышечной передачи, который связан с блокадой вхождения ионов кальция внутрь терминали аксона через потенциалозависимые кальциевые каналы. Дефицит ионов кальция ограничивает кальций-зависимое высвобождение ацетилхолина. Синтез, транспорт ацетилхолина в терминали аксона и функция постсинаптической мембраны значимо не нарушены. При одиночной стимуляции нерва выделение медиатора значительно ниже нормы, и только часть мышечных волокон активируется, М-ответ снижен. При низкочастотной стимуляции 3 Гц регистрируемый декремент напоминает аналогичный при миастении: выделение медиатора прогрессивно снижается после первого стимула за счет того, что ионы кальция недостаточно поступают в терминаль аксона. Высокочастотная стимуляция (50 Гц) приводит к накоплению кальция в терминали аксона и прогрессивному повышению выделения ацетилхолина в синаптическую щель формируя феномен инкремента («врабатывания») (рис.18).
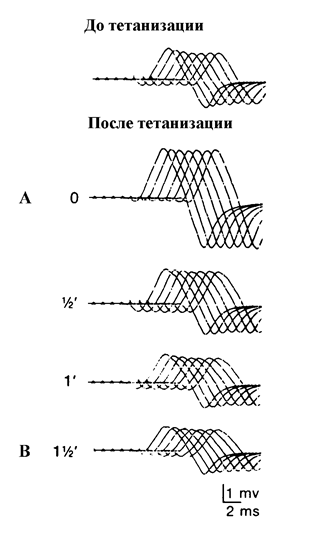
Рис. 19. Феномен посттетанического облегчения и посттетанического истощения при миастении в режиме низкочастотной стимуляции (По J.Kimura, 1978).
A – посттетаническая потенциация сразу после тетанизации,
B – посттетаническое истощение через 1,5 минуты после тетанизации.
Посттетатническое облегчение связано с накоплением ионов кальция и большим выделением медиатора в синаптическую щель. Посттетаническое истощение, как и при миастении, возникает через 2 минуты и держится до 10 минут, однако регистрируется не всегда. Улучшение синаптической проводимости при миастеническом синдроме отмечается при использовании препаратов, улучшающих вхождение ионов кальция в терминали аксонов: препараты кальция, амиридин, гуанидин.
Нарушение нервно-мышечного соединения при ботулизме имеет такие же проявления, как и при миастеническом синдроме, кроме посттетанического истощения, которое замещается затянувшимся посттетаническим облегчением до 10-15 минут. Феномены декремента и инкремента при ритмической стимуляции можно также было бы связать с косвенной ролью ионов кальция, однако средства, улучшающие функцию кальций-зависимых каналов терминалей аксонов, не улучшают нервно-мышечное проведение. Механизм нарушения нервно-мышечного соединения при ботулизме связан с нарушением взаимодействия белков мембраны синаптических везикул с мембраной терминали аксона при высвобождении ацетилхолина в синаптическую щель.
Условно формализованные морфофункциональные нарушения при различных синдромах патологии нервно-мышечной передачи приведены в таблице 3.
Таблица 3
Морфофункциональные нарушения при различных синдромах патологии
нервно-мышечной передачи
| Миастения | Миастенический синдром | Ботулизм | |
| Локализация нарушений | Постсинаптическая мембрана | Пресинаптическая мембрана | Пресинаптическая мембрана |
| Механизм нарушения | Снижение количества функционирующих холинорецепторов | Недостаточность ионов кальция, участвующих в высвобождении ацетилхолина | Нарушение взаимодействия белков мембраны везикул и пресинаптической мембраны |
| Высвобождение медиатора | Норма-снижено | Снижено | Снижено |
| Взаимодейст-вие с рецепторами постсинаптической мембраны | Недостаточно – медиатор разрушается в «поисках» незаблокированных рецепторов | Не нарушено | Не нарушено |
| Генерация постсинаптического потенциала | Недостаточна у части мышечных волокон | Недостаточна у части мышечных волокон | Недостаточна у части мышечных волокон |
При всех типах нарушения нервно-мышечной передачи понижение температуры исследуемой мышцы до 28° улучшает функцию синапса за счет: улучшения транспорта ацетилхолина, экономного расходования ацетилхолина, снижения активности холинэстеразы и повышения чувствительности холинорецепторов. Соответственно, при повышении температуры проявления миастении, миастенического синдрома и ботулизма усиливаются.
Дата добавления: 2016-03-27; просмотров: 3490;
