Уравнение Гиббса-Дюгема
1. В физической химии известно так называемое уравнение Гиббса-Дюгема.
Оно имеет весьма общий смысл, но с его помощью, в частности, можно
связать коэффициенты активности компонентов раствора. Вывод уравнения таков.
 |
а) Полная энергия Гиббса системы выражается через химические потенциалы компонентов:
 |
откуда
 |
б) С другой стороны, известно выражение:
 |
в) Сопоставление дает:
 |
или, при постоянных давлении и температуре,
2. а) Это и есть уравнение Гиббса-Дюгема, записанное для химических потенциалов. В данной записи оно означает, что для компонентов раствора изменения химических потенциалов взаимосвязаны. Например, увеличение потенциала одного компонента может происходить только за счет уменьшения потенциала другого компонента.
б) Так, увеличение концентрации растворенного вещества повышает его химический потенциал. Но в результате снижается молярная доля растворителя — значит, уменьшается его химический потенциал.
3. а) Подставим в (8.37, б) формулу (8.35, а) и поделим все на ∑ ni:
 |
б) Для двухкомпонентной системы нетрудно убедиться, что второе слагаемое
уравнения (8.38) равно нулю:
 |
 |
в) Поэтому первый член уравнения (8.38) тоже равен нулю, и это для двукомпонентной системы можно записать так:
4. Вывод таков. Если с ростом X2 уменьшается коэффициент активности растворяемого вещества 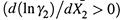 , то одновременно увеличивается коэффициент активности растворителя
, то одновременно увеличивается коэффициент активности растворителя 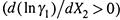 . И наоборот. Зная, как уменьшается γ2, можно рассчитать и увеличение γ1.
. И наоборот. Зная, как уменьшается γ2, можно рассчитать и увеличение γ1.
Дата добавления: 2016-03-20; просмотров: 1266;
