Растворение газов в жидкости (законы Генри и Сеченова)
Опять обратимся к растворам неэлектролитов. Некоторые особенности
имеет растворение газов.
1. а) В отличие от твердых тел, здесь растворяемое вещество тоже (как и растворитель) является летучим, поэтому можно рассматривать фазовое равновесие в системе раствор — газ над раствором.
б) Для идеального раствора к этому равновесию тоже применим закон Рауля (8.12), который в данном случае следует записать так:
 |
Следовательно, давление газа над раствором (как и любого летучего компонента раствора) пропорционально молярной доле газа в растворе. Здесь
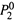 — предел, к которому стремится давление газа над раствором при X2 → 1.
— предел, к которому стремится давление газа над раствором при X2 → 1.
 |
в) Однако для реальных систем вместо
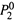 пишут эмпирическую константу Генри:
пишут эмпирическую константу Генри:
2. а) Нередко это соотношение рассматривают в обратную сторону:
 |
б) Перейдем к молярной концентрации:
 |
Тогда получаем:
 |
где Kp— константа растворимости, которую можно представить в виде:
в) Тем самым выведен закон Генри: концентрация растворенного в жидкости газапропорциональна парциальному давлению этого газа над раствором.
3. Уточним природу константы растворимости. (Сейчас она определена лишь
через другую эмпирическую константу — Kг.)
 |
а) Запишем условие равенства химических потенциалов газа в растворе и над ним:
в котором 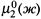 — химический потенциал растворенного газа при его единичной молярной концентрации, а
— химический потенциал растворенного газа при его единичной молярной концентрации, а 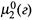 — потенциал газа над раствором при его единичном парциальном давлении.
— потенциал газа над раствором при его единичном парциальном давлении.
б) Обозначим:
 |
Тогда находим:
 |
в) Отсюда следует температурная зависимость Kp— такая же, как для константы равновесия химической реакции (п. 5.9):
г) Если 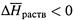 (растворение газа — экзотермический процесс), то с ростом температурыKp уменьшается, и растворимость газа снижается.
(растворение газа — экзотермический процесс), то с ростом температурыKp уменьшается, и растворимость газа снижается.
Данное явление весьма характерно для газов.
4. На растворимость газов влияют и соли, присутствующие в растворе. Это
устанавливается эмпирическим законом Сеченова:
 |
Дата добавления: 2016-03-20; просмотров: 941;
