Осмотическое давление растворов
 Следствием закона Рауля является и то, что растворы обладают так называемым осмотическим давлением, изучаемым в курсе общей химии. Суть его такова.
Следствием закона Рауля является и то, что растворы обладают так называемым осмотическим давлением, изучаемым в курсе общей химии. Суть его такова.
1. а) Пусть два отсека в системе (рис. 8.5) разделены полупроницаемой мембраной, пропускающей только растворитель; причем в отсеке I находится чистый растворитель, а в отсеке II — раствор.
б) В соответствии со вторым началом термодинамики, система стремится выравнять концентрации веществ в отсеках. Поскольку путем перемещения растворенного вещества это невозможно сделать, то перемещается растворитель — из отсека I в отсек II.
в) Так вот, осмотическое давление раствора — это давление, которое надо приложить к раствору, чтобы воспрепятствовать перемещению вещества из отсека с чистым растворителем, отделенного полупроницаемой мембраной.
 |
2. Осмотическое давление рассчитывают по формуле Вант-Гофера:
Как видно, оно равно тому газовому давлению, которым обладало бы растворенное вещество, если бы оно находилось в газообразном состоянии и занимало бы (при той же температуре) объем, равный объему раствора.
3. Вот основные моменты вывода этой формулы.
 |
а) Можно убедиться, что избыточная энергия растворителя в отсеке II определяется отношением давлений его насыщенного пара над отсеками:
 |
б) Энергия, создаваемая внешним давлением П, должна уравновешивать энергию растворителя:
 |
в) С другой стороны, исходя из определения энергии Гиббса, можно доказать,
что в данном обратимом процессе (сдавливании раствора) изменение этой энергии определяется только изменением давления (так как объем практически не меняется):
где 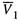 — мольный объем чистого растворителя.
— мольный объем чистого растворителя.
г) Приравнивая два выражения, получаем:
 |
Это точная формула расчета осмотического давления.
д) Переход же к формуле Вант-Гоффа (8.28) осуществляется так:
 |
где V0— объем раствора.
Первые три стадии этих выкладок — приближенные соотношения, спра-
ведливые лишь для разбавленных растворов.
8.9. Коллигативные свойства: общий перечень
1. В итоге, с законом Рауля связаны 4 явления, касающиеся влияния растворенного вещества на свойства раствора. Это
a) понижение давления насыщенного пара растворителя: ΔР1/P01= Х2, (8.17, в)
б) понижение температуры замерзания раствора: ΔТк = Kэб b2 , (8.20)
в) повышение температуры кипения: ΔTз = – Кз b2, (8.21)
г) наличие осмотического давления: П ≈ с2RT. (8.28)
2. Все эти явления объединяют в группу так называемых коллигативных свойств растворов.
а) Термин означает, что выраженность данных свойств зависит только от
количества частицрастворенного вещества в единице объема и не зависит от
их природы.
б) Однако такое утверждение (равно как и выписанные соотношения) спра-
ведливо только для идеальныхрастворов. В случае же неидеальныхрастворов
имеет значение и природа растворенного вещества.
Активности веществ
В вышеприведенных выражениях для коллигативных свойств растворов
фигурируют концентрации растворенных веществ. Использовались концентра-
ции и тогда, когда записывались формулы для константы равновесия, энергии
Гиббса химической реакции, химического потенциала, например:
 |
1. а) Но на самом деле, как уже отмечалось для химического потенциала (6.9, б), во всех этих формулах следует писать не просто концентрации, а так называемые эффективные концентрации, или активностивеществ. Последние связаны с обычными концентрациями с помощью коэффициентов активности:
 |
причем индексы (X, с, b) в обозначениях активности обычно не пишут. Так что под активностью иногда понимают эффективную молярную долю, в других случаях — эффективную молярную концентрацию, а в третьих — эффективную моляльную концентрацию.
б) С учетом сделанного замечания дадим определение. Активность вещества в растворе — это концентрация идеального раствора, которая требуется для проявления точно таких же коллигативных, химических и прочих свойств, как у данного реального раствора.
в) Следовательно, чтобы на практике определить коэффициент активности, необходимо измерить какое-либо свойство раствора, по соответствующей формуле рассчитать эффективную концентрацию и сравнить последнюю с истинной концентрацией.
 |
2. Пример. Пусть для раствора вещества с c2 = 0,1 М измерили осмотическое давление и по формуле Вант-Гоффа нашли, что такое же давление создает идеальный раствор с концентрацией


Тогда коэффициент активности равен
 3. При очень низких концентрациях вещества коэффициент активности близок к 1,0 (рис.8.6); при повышении концентрации он снижается (становясь много меньше 1,0); при еще большем увеличении концентрации начинает повышаться и порой даже становится больше 1,0. Некоторые значения коэффициента активности для СаСl2 приведены в табл. 8.2.
3. При очень низких концентрациях вещества коэффициент активности близок к 1,0 (рис.8.6); при повышении концентрации он снижается (становясь много меньше 1,0); при еще большем увеличении концентрации начинает повышаться и порой даже становится больше 1,0. Некоторые значения коэффициента активности для СаСl2 приведены в табл. 8.2.
4. Почему активность обычно отличается от концентрации?
Все дело во взаимодействии частиц вещества друг с другом. Например, ионы K+ и Cl–, на которые распадается в растворе KCl, создают друг вокруг друга многочисленные ионные оболочки. Поэтому некоторая доля частиц как бы выключается из взаимодействия с растворителем и другими компонентами раствора.
5. Итак, в выражениях, где до сих пор писались концентрации, на самом деле
надо писать активности, например:
μi = μ0i + RT ln (γi Xi) ,(8.35,а)
(aC)c (aD)d
ΔGрц = ΔG0рц + RT ln –––––––––– = ΔG0рц + RT lnПа .(8.35,б)
(aA)a (aB)b
Дата добавления: 2016-03-20; просмотров: 978;
