Способы выражения концентрации растворов
1. При изложении материала будут использованы различные способы выражения концентрации растворов, известные из курса общей химии. Полезно вспомнить основные определения и записать несколько соотношений, которые позволяют переходить от одного вида концентрации к другому.
 |
Сведем эти формулы в табл. 8.1, где ρ0— плотность раствора.
2. а) Таким образом,
- молярная концентрация — это количество вещества (в молях) в одном литре раствора,
- а моляльная концентрация — то же количество вещества, но отнесенное к одному килограмму растворителя.
б) Молярная (или массовая) доля — доля
- от общего количества всех веществ в растворе (в молях) или
- от общей массы всех веществ (в граммах, килограммах),
приходящаяся на данное вещество.
3. Вывод соотношений связи (приведенных в правом столбце таблицы) легко производится из исходных определений. Приведенные формулы запоминать не следует, поскольку можно получить очень много вариантов таких формул.
 |
4. Еще раз коснемся связи между молярной концентрацией (с) и молярной долей (Х). Предварительно выразим с через Xследующим образом:
 |
а) Отсюда видно, что для двух компонентов раствора отношения молярных концентраций и молярных долей одинаковы:
 |
б) Но этого нельзя сказать, если мы сравниваем две концентрации (
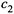 и
и 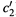 ) одного и того же компонента:
) одного и того же компонента:
Здесь молярная концентрация пропорциональна молярной доле только для
разбавленных растворов, где n1 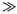 n2 (и n1
n2 (и n1 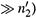 .
.
в) Это обстоятельство надо иметь в виду, когда, например, в формуле для химического потенциала переходим от молярной концентрации к молярной доле (6.7—6.10).
 |
5. Получим еще одно соотношение связи — формулу расчета молярной доли
через моляльную концентрацию:
Приближение справедливо для разбавленных растворов (при малом b2).
Заметим: молярную массу здесь следует измерять в кг/моль.
8.3. Термодинамика растворения: газовые растворы
Кратко рассмотрим, как изменяется энергия Гиббса системы при образовании раствора.
 а) Пусть два газа (1 и 2) имеют одинаковое давление Р и разделены перегородкой (рис. 8.2, а). Если перегородку убрать, газы смешаются (рис. 8.2,6), причем общее давление не изменится, а парциальное давление каждого газа снизится до величины
а) Пусть два газа (1 и 2) имеют одинаковое давление Р и разделены перегородкой (рис. 8.2, а). Если перегородку убрать, газы смешаются (рис. 8.2,6), причем общее давление не изменится, а парциальное давление каждого газа снизится до величины
Pi = PXi , (8.5)
где Xi — молярная доля газа в образовавшейся смеси.
б) Образующийся газовый раствор считается идеальным. Значит, при его образовании сила и характер
межмолекулярных взаимодействий не меняется (ΔН = 0). Следовательно, все изменение энергии Гиббса обусловлено возрастанием энтропии каждого газа.
 |
в) Используя формулы (4.7,6) и (3.21,6), для какого-либо одного газа получаем:
г) Поскольку Xi < 1, то ΔGi < 0. Суммарное изменение энергии Гиббса имеет вид:
 |
д) Если еще учесть определение молярной доли (табл. 8.1), то результат можно записать и так:
Дата добавления: 2016-03-20; просмотров: 572;
