Диаграмма состояния серы
1. а) У твердой серы (см. п. 7.1) имеются две модификации — ромбическая
и моноклинная. В природе обычно встречается ромбическая форма, при на-
гревании выше Tпер = 95,4° С (при нормальном давлении) постепенно превра-
щающаяся в моноклинную. При охлаждении происходит обратный переход.
Такие обратимые превращения модификаций называются энантиотропными.
б) Итак, при указанной температуре обе формы находятся в равновесии:

причем переход в прямом направлении сопровождается увеличением объема. Естественно, что, по принципу Ле Шателье, температура перехода (Tпер) зависит от давления. Повышение давления (ΔP > 0) будет сдвигать равновесие в сторону с меньшим объемом (Sромб), так что для перехода в Sмон потребуется бόльшая температура Tпер (ΔTпер> 0).
в) Таким образом, здесь знаки ΔP и ΔTпер совпадают: наклон кривой Tпер(P) — положительный. На диаграмме состояния (рис. 7.3) эта зависимость отражена почти прямой линией АВ.
2. а) Всего же фаз у серы — 4: две названные твердые, а также жидкая и газообразная. Поэтому на диаграмме состояния — 4 области, соответствующие этим фазам. А разделяются фазы шестью линиями, которыесоответствуют шести видам фазовых равновесий:


б) Без подробного рассмотрения всех этих областей и линий коротко укажем для них следствия из правила фаз (практически такие же, как для воды):
I. в каждой из 4-х областей – состояние бивариантное:
Ф= 1 и С = 3 – 1 = 2 , (7.9,а-б)
II. а на каждой из 6-ти линий – состояние моновариантное:
Ф = 2 и С = 3 – 2 = 1 . (7.10,а-б)
III. Кроме того, имеются сразу 3 тройные точки (А, В, С), для которых
Ф = 3 и С = 3 – 3 = 0 .(7.11,а-б)
В каждой из них, как в тройной точке диаграммы воды, существуют одновременно три фазы, и подобные состояния – инвариантны, т.е. нельзя изменить ни одного параметра (ни температуры, ни давления), чтобы не «потерять» хотя бы одну из фаз.
7.5. Уравнение Клаузиуса-Клайперона: общая форма
Получим уравнения, определяющие ход линий фазового равновесия, т.е.
- зависимость давления насыщенного пара (над жидкостью или твердой фазой) от температуры и
- зависимость температуры плавления от внешнего давления.
1. а) Обратимся к молярной энергии Гиббса, т. е. к химическому потенциалу:

(Черта над величинами означает, что они относятся к 1 молю вещества.)
 б) Условие химического равновесия (6.4, б) между фазами однокомпонентной системы имеет вид:
б) Условие химического равновесия (6.4, б) между фазами однокомпонентной системы имеет вид:
в) Из этого условия, в частности, следует, что при переходе 1 моля вещества из одной фазы в другую его энергия Гиббса не меняется:

Здесь индексы «ф.п.» означают фазовый переход,  и
и 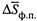 — теплота (энтальпия) и энтропия данного перехода (в расчете на 1 моль вещества).
— теплота (энтальпия) и энтропия данного перехода (в расчете на 1 моль вещества).
2. а) С другой стороны, энергия Гиббса равновесного процесса зависит от температуры и давления:

Для вышеуказанного перехода 1 моля вещества из одной фазы в другую это
выглядит следующим образом:

где 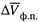 — изменение мольного объема в результате фазового превращения.
— изменение мольного объема в результате фазового превращения.
б) Однако чтобы, несмотря на изменение температуры или давления, в нашей
системе сохранялось межфазное равновесие, по-прежнему должны выполняться все известные нам условия — термического, динамического и химического равновесия между фазами, т.е. остается справедливым и равенство (7.14,a).
 |
Если левую часть уравнения (7.15) приравнять нулю, получаем:
3. а) Этот результат показывает, что изменения давления и температуры при фазовом равновесии не могут быть независимыми друг от друга. При произвольном изменении внешней температуры фазовое равновесие сохраняется только при соответствующем изменении давления, и наоборот.
б) Выражение (7.16) — наиболее общая форма уравнения Клаузиуса-Клайперона, связывающего давление и температуру фазовых переходов. Из него и следуют те две зависимости, которые определяют ход линий фазового равновесия на диаграмме состояния.
Дата добавления: 2016-03-20; просмотров: 1441;
