Теплоты физико-химических процессов
Не только химические, но и физико-химические процессы могут сопровождаться выделением или поглощением теплоты.
В связи с этим, рассмотрим три типичных физико-химических процесса.
1. Растворение веществ.
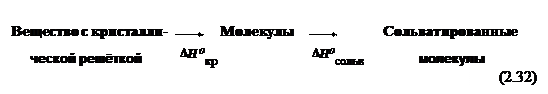 |
а) Если это твердое вещество, то процесс можно представить в две стадии:
На первой стадии разрушается кристаллическая решетка, на второй происходит сольватация (например, гидратация) молекул вещества. Обычно первая стадия — эндотермическая, вторая — экзотермическая:
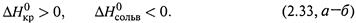 |
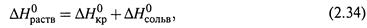 |
Результирующая же теплота растворения равна сумме теплот двух стадий:
и может иметь как положительный, так и отрицательный знак.
б) А вот ситуации, когда присутствует только одна из двух названных стадий.
I. При растворении газов, очевидно, нет первой стадии — разрушения
кристаллической решетки. Остается экзотермическая сольватация. Поэтому
растворение газов, как правило, экзотермично.
II. При растворении кристаллогидратов отсутствует стадия сольватации.
Остается лишь эндотермическое разрушение кристаллической решетки. Процесс идет с поглощением теплоты.
в) В качестве примераприведем растворение сульфата меди — в первом случае кристаллогидрата, а во втором — безводной соли:
 |
2. Реакция нейтрализации.
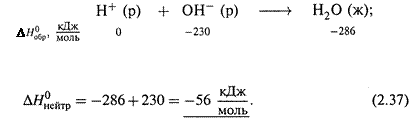 |
а) Сильные кислоты и основания в растворе диссоциированы полностью, и поэтому теплота нейтрализации (независимо от их природы) одна и та же.
Рассчитаем ее:
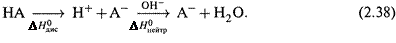 |
б) Если же в подобной реакции участвует слабый электролит (у которого диссоциирована лишь небольшая часть молекул), то процесс можно записать в две стадии:
Первая стадия — это ионизация слабого электролита. Она обычно является эндотермической, т.е. для полной ионизации всех молекул слабого электролита требуется передать веществу теплоту. И чем слабее кислота, тем больше надо теплоты.
Итак, в реакции нейтрализации, идущей с участием слабого электролита, результирующее выделение энергии оказывается меньше, чем в случае сильного электролита.
в)Примеры.
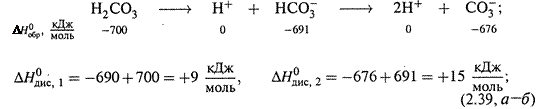 |
I. Диссоциация угольной кислоты:
II. Реакция нейтрализации угольной кислоты щелочью:
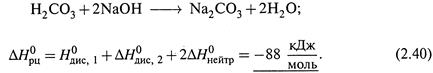 |
3. Фазовые превращения
а) Теплота фазового перехода равна разности ΔНообр вещества в одном и в другом состояниях.
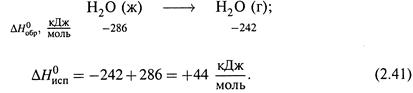 |
б) Например, для испарения воды (при 25 °С) имеем:
Таким образом, парообразование – это эндотермический процесс.
в) Как меняется теплота испарения при повышении температуры? Для ответа на этот вопрос будем считать, что испарение – это аналог химической реакции, и применим уравнение Кирхгофа.
В п. 2.4 мы видели, что теплоёмкость воды («реагента») значительно больше, чем теплоёмкость идеального газа. А пар («продукт реакции») отчасти подобен такому газу. Поэтому
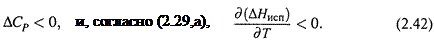 |
Следовательно, при нагревании теплота испарения снижается.
И действительно – при 100°С
ΔHисп (Н2О) = + 41 кДж/моль < ΔH°исп (Н2О) . (2.43)
Краткое содержание главы 2
1. Для условий, в которых обычно проходят химические реакции, теплота реакции есть функция состояния. Это констатирует ЗАКОН ГЕССА: теплота реакций не зависит от способа их осуществления.
2. Более общим понятием является ЭНТАЛЬПИЯ – такая функция состояния, изменение которой в изобарном процессе равно теплоте:
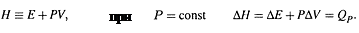 |
3. Используя энтальпии (теплоты) образования или сгорания веществ, рассчитывают ТЕПЛОТЫ РЕАКЦИЙ:
 |
4. В главе также введены МОЛЯРНАЯ ТЕПЛОЁМКОСТЬ и два её частных вида:
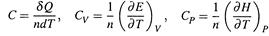 |
5. Через эти величины выражается зависимость теплоты реакции от температуры (УРАВНЕНИЯ КИРХГОФА):
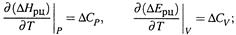 |
6. И, наконец, были рассмотрены теплоты ряда физико-химических процессов – растворения веществ, фазовых превращений и диссоциации слабых электролитов.
Дата добавления: 2016-03-20; просмотров: 1380;
