Следовательно, каким бы ни было направление теплопередачи и работы, изменение внутренней энергии в процессе есть алгебраическая сумма переданной теплоты и совершенной работы.
4. Отметим принципиальную разницу между фигурирующими здесь величинами.
а) Как известно, Е(внутренняя энергия) — функция состояния. Значит, по общему свойству таких характеристик (п. 1.1), ΔЕне зависит от способа перехода системы из одного состояния в другое.
б) Но этого нельзя сказать о теплоте и работе. Пример с газом (п. 1.3) показал, что при обратимом и необратимом способах расширения газ совершает разную работу.
Следовательно, будет различной и теплота процесса (так как ΔЕ = const).
Таким образом, в общем случае ни w, ни Q не являются функциями состояния.
1.5. Первое начало термодинамики для различных процессов
в системе идеального газа
В случае системы идеального газа можно выделить такие частные типы процессов, в которых постоянна какая-либо из термодинамических величин.
Некоторые (но не все!) соотношения, получаемые для них, могут быть распространены и на другие системы — например, растворы.
1. Изотермические процессы(идут при постоянной температуре: Т — const).
а) Для их осуществления расширение или сжатие газа надо сочетать с подведением или забором теплоты — так, чтобы температура газа оставалась постоянной.
б) Согласно (1.2, с), для идеального газа внутренняя энергия зависит только от температуры. Следовательно, при Т = const
 |
Таким образом, при изотермическом расширениигаза вся подводимая извне теплота трансформируется в работу газа, а при сжатиигаза отводимая теплота равна работе, совершаемой над газом.
Конкретная величина работы и теплоты зависит от способа проведения процесса, что выражается формулами (1.4) и (1.6).
в) Но соотношения (1.8, а–б) справедливы только для идеального газа.
Представим химическую реакцию в изотермических условиях. Здесь внутренняя энергия системы уже, как правило, изменяется, так что
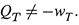 |
2. Изобарные процессы(идут при постоянном давлении, Р = const).
а) Вот пример изобарного процесса: нагревают газ, который, сохраняя свое давление, расширяется и совершает работу против постоянного внешнего давления.
б) В силу того, что внешнее и внутреннее давления при этом все время одинаковы, процесс является обратимым.
 |
в) А благодаря постоянству давления величина работы против него не зависит от способа совершения процесса:
т.е. определяется только начальным и конечным состояниями системы ΔV. Следовательно, работа является функцией состояния.
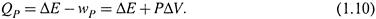 |
г) Отсюда вытекает, что и теплота изобарного процесса является функцией состояния:
Данный вывод можно распространить на любую систему, если в ней в ходе изобарного процесса не совершается никакой иной работы, как против давления.
3. Изохорные процессы (V = const).
Пример — нагревание газа под зафиксированным поршнем.
 |
Естественно, что работа при этом не совершается:
Получается, что и здесь теплота — функция состояния, поскольку таковой является равная ей величина 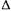 Е .
Е .
4. Адиабатические процессы — это процессы, при которых исключен теплообмен системы с окружающей средой:
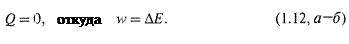 |
В этих случаях функцией состояния становится работа.
Краткое содержание главы 1
1. Введены общие понятия – ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА, её состояния и характеристики, а также ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ.
2. В отношении каждого из этих понятий дана соответствующая классификация.
а) Системы делятся на ИЗОЛИРОВАННЫЕ, ЗАКРЫТЫЕ И ОТКРЫТЫЕ;
б) характеристики системы – на ПАРАМЕТРЫ СОСТОЯНИЯ и ФУНКЦИИ СОСТОЯНИЯ;
в) среди самих состояний различают СТАНДАРТНОЕ, РАВНОВЕСНЫЕ (каковым является и стандартное), СТАЦИОНАРНЫЕ и ПЕРЕХОДНЫЕ;
г) среди процессов – ОБРАТИМЫЕ и НЕОБРАТИМЫЕ (что не совпадает с необратимостью в химическом смысле).
3. Сформулировано ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ:
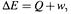 |
где E – внутренняя энергия системы, Q – теплота (переданная системе или системой), а w – работа (совершаемая системой или над системой).
4. а) Констатировано, что в общем случае теплота и работа зависят от способа перехода системы из одного состояния в другое.
б) Однако для изобарных и изохорных процессов такой зависимости нет:
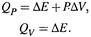 |
Здесь теплота (и работа, если она совершается) является уже ФУНКЦИЕЙ СОСТОЯНИЯ.
Дата добавления: 2016-03-20; просмотров: 576;
