Термодинамические системы, состояния и характеристики
1. В термодинамике объектом рассмотрения всегда является система.
Термодинамическая система — любой объект природы, состоящий из достаточно большого количества частиц (не менее 1010 —1013) и отделенный реальной или воображаемой границей от окружающей среды.
2. Различают 3 типа термодинамических систем (табл. 1.1):
а)Изолированныесистемы — не могут обмениваться с окружающей средой ни энергией, ни массой. Примеры: изолированный термостат, Вселенная в целом.
Таблица 1.1

б)Закрытыесистемы — могут обмениваться с окружающей средой энергией, но не массой. Пример закрытой системы — совокупность молекул растворенного вещества. Внешней же средой здесь является все остальное, начиная с растворителя (если он не участвует в реакции). Поэтому в химической термодинамике наиболее часто рассматривают именно закрытые системы.
в) Открытые системы — это системы, которые могут обмениваться с окружающей средой и энергией, и массой. Здесь самый важный пример — живые объекты.
3. Какую бы систему мы ни взяли, она может быть в различных состояниях. А чтобы описать то или иное состояние, используют термодинамические характеристики (аi).
Эти характеристики можно классифицировать двумя способами.
а) Во-первых, их делят на экстенсивные и интенсивные.
I. Экстенсивныепараметры зависят от количества вещества и складываются при сложении однородных компонентов:
а0 = Σ аi . (1.1)
Примеры — объем (V), масса (т), количество вещества (п), энергия (Е), относящиеся ко всей системе или к отдельным ее частям.
II. Интенсивные характеристики не зависят от количества вещества и выравниваются при контакте систем или частей системы. Сюда относятся такие параметры, как температура (Т), давление (Р), плотность (ρ), концентрация (с).
б) Другое подразделение таково.
I. Одни характеристики можно рассматривать как основные, которые определяют состояние вещества. Их называют параметрами состояния. Обычно в качестве таковых берут следующие характеристики — Т, Р и п, т. е. температуру, давление и количество вещества.
II. Остальные характеристики зависят от этих трех параметров, а значит,.в целом от состояния системы. Поэтому их называют функциями состояния. Так, для идеального газа энергия определяется только температурой и количеством вещества, а объем — всеми тремя параметрами состояния:
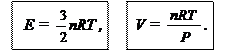 |
(1.2,а-б)
Первое выражение известно из физики, а второе — это уравнение Клайперона—Менделеева (PV = nRT).
Связь между параметрами и функциями состояния представлена на рис. 1.1.

4. Сформулируем свойство функций состояния.
а) Значение любой из них не зависит от способа достижения системой данногосостояния, а зависит только от самого этого состояния.
б) Для некоторых состояний используются специальные термины. Так, часто вещества (системы) рассматривают при стандартных условиях:
Т = 25° (298 К), Р=1 атм (101,3 кПа), п = 1 моль. (1.3, а–в)
Соответственно, стандартное состояние вещества — это 1 моль чистого вещества при стандартных температуре и давлении в наиболее устойчивом агрегатном состоянии.
Как видно, к условиям (1.3, а—в) здесь добавляется еще условие о наиболее устойчивом агрегатном состоянии. Для одного вещества это газообразное состояние, для другого — жидкое, для третьего — твердое в наиболее распространенной аллотропной модификации.
в) И стандартные, и многие другие состояния являются равновесными. В равновесном состоянии параметры состояния не изменяются самопроизвольно со временем, и в системе отсутствуют потоки вещества и энергии.
г) Наконец, еще один важный частный случай состояний — это стационарные состояния. Здесь параметры состояния тоже постоянны, но в системе имеются потоки энергии и (или) вещества.
д) Все прочие состояния системы являются, по существу, переходными— либо к равновесному, либо к стационарному состоянию.
Дата добавления: 2016-03-20; просмотров: 1038;
