Зависимость теплоты реакции от температуры
В ряде случаев (хотя не всегда) теплота реакции (величина ΔНорц) зависит от температуры.
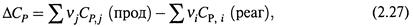 |
1. Наличие этой зависимости и сам ее характер определяется разностью теплоемкостей продуктов и реагентов, то есть (при постоянном давлении) величиной
где ni и nj — по-прежнему стехиометрические коэффициенты реакции.
а) Действительно, пусть данная разность — положительная, т.е. образуются более теплоемкие вещества. Тогда при нагревании системы все большая часть теплоты должна как бы оставаться в продуктах реакции.
Следовательно, выделение теплоты в реакции уменьшается.
А это значит, что величина ΔН (с учетом знака) возрастает: например, с –200 кДж/моль до –100 кДж/моль.
б) Аналогично, еслиΔСР < 0,то образуются менее теплоемкие вещества: при нагревании они поглощают меньше теплоты, чем реагенты, отчего больше теплоты выделяется в ходе реакции, а величина ΔНорц уменьшается.
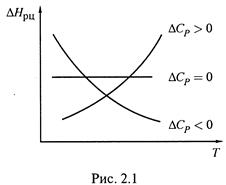 Соответствующие зависимости показаны на рис. 2.1.
Соответствующие зависимости показаны на рис. 2.1.
2. Теперь установим конкретный характер этой зависимости. Вновь обратимся к простейшей реакции А → В..
а) В расчете на 1 моль реагента или продукта находим, с учетом (2.22, б):
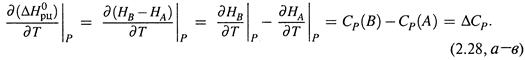 |
б) Тем самым получаем уравнения Кирхгофа:
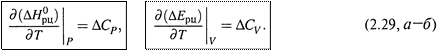 |
Второе из них выводится аналогично первому.
в) Как видим, и для изобарного, и для изохорного процесса производная теплоты по температуре равна ΔС (соответственно, ΔСР или ΔСV). Характерно, что совпадают и знаки этих величин.
г) Поэтому, если ΔСР < 0 (т.е. продукты – менее теплоемкие), то теплота реакции при нагревании снижается.
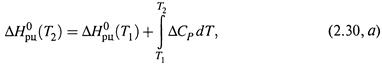 |
3. а) Для практических целей уравнение Кирхгофа используют в интегральной форме:
где ΔНорц — энтальпия реакции при температуре T0 .
б) В принципе, теплоемкости веществ зависят от температуры, отчего ΔСР — тоже какая-то функция температуры. Это затрудняет точное интегрирование в формуле (2.30, а).
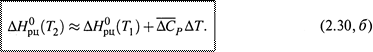 |
Но часто ограничиваются приближенным расчетом, где используют средние значения теплоемкостейвеществ на рассматриваемом интервале температур (причем, средние арифметические значения, что и обуславливает приближенность расчета):
в) Итак, зная теплоту реакции при T1, можно оценить теплоту реакции при T2 .
4. Но обычно изменение ΔНорц при нагревании не очень велико.
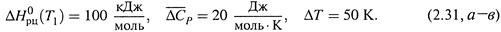 |
а) Так, допустим, что
Тогда подстановка в формулу (2.30,б) дает:
 |
Следовательно, теплота реакции на интервале в 50 К изменяется всего на 1 % (cо 100 кДж/моль до 101).
б) Если теплоемкости реагентов и продуктов еще ближе по величине, то и изменение энтальпии будет еще меньше. Поэтому очень часто считают, что ΔНорц практически не зависит от температуры.
Дата добавления: 2016-03-20; просмотров: 1062;
