Термодинамические процессы
1. а) Всякое изменение параметров состояния (т. е. переход системы из одного состояния в другое) есть термодинамический процесс.
б) К процессу приводит осуществляемое каким-то внешним воздействием выведение системы из равновесного состояния(т. е. перевод ее в неравновесное состояние).
в) В результате же самопроизвольного процесса система
- либо возвращается в прежнее состояние равновесия,
- либо переходит в какое-то иное равновесное состояние,
- либо достигает стационарного состояния.
2. Обратим здесь внимание на два обстоятельства.
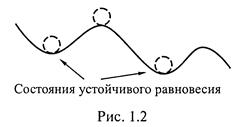
а) Во-первых, система может иметь несколько состояний равновесия, как это показано на рис. 1.2.
б) Во-вторых, если система достигает стационарного состояния, то процесс не прекращается, а просто становится стационарным(т. е. таким, при котором поддерживаются постоянные значения параметров состояния).
 Такая ситуация может иметь место в закрытых и открытых системах. Например, здоровый человек находится в стационарном состоянии: все его параметры остаются на постоянном уровне. Но в нем все время идут процессы обмена с окружающей средой веществом и энергией, и многие из этих процессов являются стационарными.
Такая ситуация может иметь место в закрытых и открытых системах. Например, здоровый человек находится в стационарном состоянии: все его параметры остаются на постоянном уровне. Но в нем все время идут процессы обмена с окружающей средой веществом и энергией, и многие из этих процессов являются стационарными.
3. Когда система стремится к равновесному состоянию, а когда — к стационарному?
В случае открытой системы можно указать на две типичные ситуации.
а) Пусть на границах системы — постоянные и одинаковые значения интенсивного параметра (например, концентрации вещества).
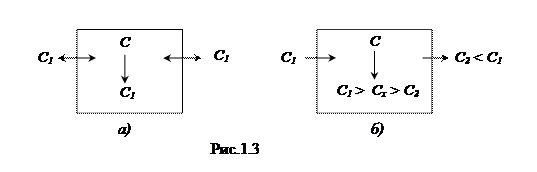 |
Тогда концентрация в самой системе (изначально отличная) тоже стремится к тому же значению, которое является равновесным (рис. 1.3,а), т.е. после его достижения процесс прекратится.
б) А теперь пусть на границах открытой системы — постоянные, но различные значения интенсивного параметра (концентрации). Тогда в результате переходного процесса в системе устанавливается какая-то промежуточная концентрация сх , которая затем будет поддерживаться благодаря стационарному процессу — притоку вещества через одну границу и такому же по величине оттоку через другую границу (рис. 1.3, б).
Таким образом, достигается стационарное состояние.
4. Обратимые и необратимые процессы. Принципиальное для термодинамики значение имеет подразделение всех процессов на обратимые и необратимые. В этом подразделении учитывается, как система переходит из начального состояния в конечное.
а)Обратимые процессы — такие, в которых малейшее противоположное воздействие меняет направление на обратное.
Это означает, что все промежуточные состояния системы и окружающей среды в таком процессе — равновесные. Поэтому часто обратимые процессы называют еще равновесными.
б)А термодинамически необратимые процессы — такие, которые не могут быть обращены без того, чтобы в самой системе или в окружающей среде не остались какие-то изменения.
Из этого определения следует: после термодинамически необратимого процесса систему при определенных условиях можно вернуть в исходное состояние (т. е. осуществить химическую обратимость).
Но для этого требуется произвести какие-либо изменения в системе или окружающей среде — например, повысить концентрацию продуктов реакции или подвести дополнительную теплоту.
Таким образом, термодинамическая необратимость и химическая необра-тимость — понятия различные.
Заметим: практически каждый реальный процесс в той или иной мере термодинамически необратим. Но представление об идеально обратимом процессе очень полезно.
1.3. Пример: изотермическое изменение объема газа
Иллюстрация различных способов перехода системы из одного состояния в другое — изотермическое расширение газа — представлена на рис. 1.4.
1. В крайнем варианте необратимогопроцесса внешнее давление сразу снижают до уровня Р2 .
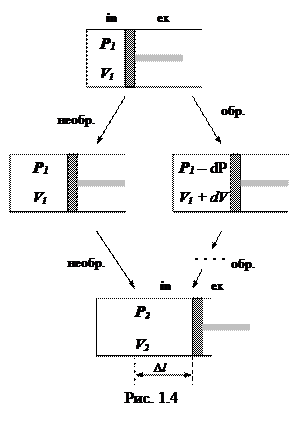 Тогда газ под поршнем резко расширяется до объема
Тогда газ под поршнем резко расширяется до объема
V2 = V1P1/P2 ,
совершая работу против малого внешнего давления Р2:
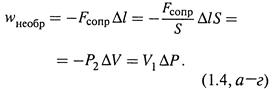
2. А в обратимом варианте расширения внешнее давление снижают очень медленно, — так что газ вначале совершает работу против давления Р1 – dP, затем — против Р1 – 2dP, ... и лишь в конце — против Р2.
Очевидно, что при этом работа газа больше, чем в предыдущем случае. Рассчитаем конкретную величину данной работы:
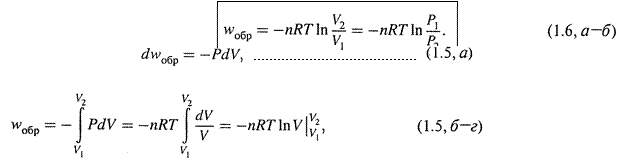 |
откуда
3.Теперь допустим, что газ после того или иного его расширения вновь изотермически сжимают до прежнего объема V1.
а)В обратимом варианте придется совершить над системой точно такую же работу, какую совершала система при расширении. Никаких изменений в системе или окружающей среде не останется.
б) I. При необратимом же варианте работа сжатия окажется больше, чем при расширении. Действительно, давление газа не будет оставаться всё время сжатия на низком уровне Р2 , а будет возрастать с Р2 до Р2.
II. И для обеспечения этой избыточной работы окружающей среде придётся затратить дополнительное количество энергии. Что и означает какое-то изменение этой среды в результате цикла.
Дата добавления: 2016-03-20; просмотров: 604;
