Основные законы термохимии и термохимические расчеты
Во всех химических явлениях выполняется закон сохранения энергии. Соответственно и все законы термохимии являются следствием первого начала термодинамики.
В 1840 г. Г. И. Гесс установил основной закон термохимии: тепловой эффект химической реакции зависит только от начального и конечного состояния реагирующих веществ и не зависит от пути, по которому реакция протекает.
Этот закон также является частным случаем первого начала термодинамики применительно к химическим реакциям, протекающим в изохорных или изобарных условиях.
Так, диоксид углерода можно получить непосредственно, сжигая углерод в кислороде, или же сначала сжигать его до оксида (СО), а затем уже до диоксида углерода.
Эти два пути можно изобразить в виде следующей схемы:
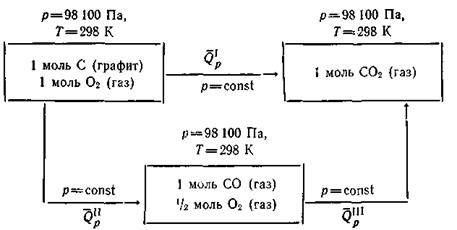
В обоих случаях начальные состояния системы С и О2 и конечное состояние СО2 одинаковы. Суммарные тепловые эффекты равны для первого пути реакции
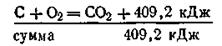
для второго пути реакции
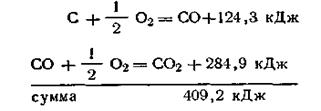
Как видим, тепловой эффект первого процесса равен суммарному тепловому эффекту второго процесса.
Закон Гесса имеет большое практическое применение. Он дает возможность вычислять тепловые эффекты, не проводя химических реакций. Этот закон выполняется также в физиологии и в биохимии. Так, количество теплоты, получаемой от окисления пищевых продуктов в организме в результате целой серии сложных реакций, и количество теплоты, выделяемое при сжигании этих веществ в калориметрической бомбе, оказались тождественными (табл. 1.3).
В табл. 1.3 приведены средние данные, так как различные углеводы, белки и жиры имеют свои индивидуальные особенности, не полностью окисляются в организме и т. д. В качестве продукта неполного окисления белков из организма выделяется мочевина. Именно этим объясняется, что при полном сжигании белка в калориметрической бомбе теплоты выделяется больше, чем при окислении его в живом организме.
В термохимических расчетах часто пользуются следствиями, которые непосредственно вытекают из закона Гесса.
Следствие первое.Количество теплоты, необходимое для разложения сложного вещества на более простые, равно количеству теплоты, выделяющемуся при его образовании из простых веществ (закон Лавуазье — Лапласа).
Так, теплота образования одного моля окиси кальция из кальция и кислорода 634,71 кДж, т. е.
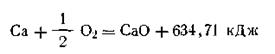
Соответственно для разложения одного моля СаО на кальций и кислород необходимо затратить 634,71 кДж, т. е.
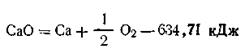
 Закон Лавуазье — Лапласа является частным случаем закона сохранения энергии. Он выполняется при образовании химических соединений из более сложных веществ. Например, теплота образования Li2СО3 из Li2O и СО2 равна
Закон Лавуазье — Лапласа является частным случаем закона сохранения энергии. Он выполняется при образовании химических соединений из более сложных веществ. Например, теплота образования Li2СО3 из Li2O и СО2 равна
226,77 кДж. Для разложения же 1 моль Li2CO3 на исходные оксиды Li2O и СО2 необходимо затратить также 226,77 кДж энергии.
Следствие второе. Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет тепловой эффект перехода из одного начального состояния в другое. Это следствие используется в термохимических расчетах. Например, тепловые эффекты при сжигании угля высокой степени чистоты, алмаза и графита до двуокиси углерода следующие:
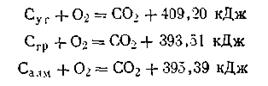
Пользуясь следствием из закона Гесса, можно рассчитать тепловые эффекты перехода из одного аллотропного состояния в другое. Так, при переходе от угля к графиту выделяется 409,20— 393,51 = 15,69 кДж/моль; при переходе от алмаза к графиту — 395,39—393,51 = 1,88 кДж/моль; при переходе от графита к алмазу поглощается 393,51—395,39 =—1,88 кДж/моль.
Следствие третье. Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет тепловой эффект перехода из одного конечного состояния в другое. Это следствие также используется при расчетах. Например, сжигая углерод и окись углерода до двуокиси углерода, можно опытным путем определить их тепловые эффекты:

Вычитая уравнение (б) из уравнения (а), можно вычислить тепловой эффект реакции сжигания углерода до окиси углерода:
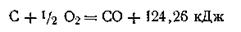
Тепловой эффект этой реакции экспериментальным путем определить очень трудно, потому что невозможно сжечь уголь до окиси углерода без того, чтобы не образовалась частично и двуокись углерода.
Закон Гесса дает возможность определять тепловые эффекты таких реакций, которые или не реализуемы, или не могут быть проведены чисто и до конца. На основании этого закона с термохимическими уравнениями можно производить те же действия, что и с обычными алгебраическими уравнениями. Исходя из этого, только что рассмотренный пример можно записать в следующем виде:
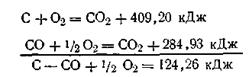
или после перестановки членов уравнения
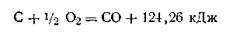
Основным методом определения тепловых эффектов реакции является калориметрический.
Однако, существует и метод, позволяющий определить тепловые эффекты фазовых превращений в механических смесях, а, следовательно, и фазы, которые там находятся.
Качественный фазовый (или термографический) анализ основан на том, что большинство тепловых эффектов, протекающих в веществе, остается неизменным независимо от того, находится взятое вещество в чистом виде или же в смеси с другими солями, если только вещества, входящие в данную смесь, не вступают в химическое взаимодействие. Этот анализ, так же как и идентификация индивидуальных минералов, проводится с использованием эталонных термограмм.
Дата добавления: 2016-02-20; просмотров: 3484;
