Предмет термодинамики. Основные термодинамические понятия
Термодинамика изучает взаимные превращения различных видов энергии, связанные с переходом энергии между телами в форме теплоты и работы.
Теплота и работа рассматриваются в термодинамике как количественные характеристики двух форм обмена энергией между телами (системой) и окружающей средой. При этом теплота характеризует обмен энергией в форме кинетической энергии теплового, т. е. хаотического, движения частиц (атомов, молекул, электронов и т. п.), а работа — в форме кинетической энергии направленного, упорядоченного движения частиц.
Термодинамика базируется на двух основных законах, получивших название первого и второго начал термодинамики. Оба начала выведены из обобщения практического опыта.
Химическая термодинамика изучает не только соотношения между химической и другими видами энергии, но исследует возможности и предел самопроизвольного протекания химического процесса в конкретных условиях. Химическая термодинамика необходима для сознательного управления физико-химическими процессами, лежащими в основе химического производства.
Применение термодинамического метода расчета в технологии различных химических производств оказало в дальнейшем огромное влияние на развитие всей химической промышленности. Термодинамический метод в настоящее время широко применяется в металлургических процессах, при производстве пластмасс, удобрений, химических волокон, при химической переработке топлива. В последние годы получила бурное развитие биологическая термодинамика, где методы термодинамики применяются при изучении процессов, протекающих в растительных и животных организмах.
Однако термодинамический метод исследования физико-химических превращений имеет свои недостатки и ограничения. В частности, предсказывая возможность и полноту прохождения реакции в данных условиях, термодинамика не дает представления о времени, которое необходимо для протекания реакции. Время как параметр, характеризующий интенсивность процесса, не входит в уравнения термодинамики. Термодинамический метод применим только к макросистемам. Им нельзя пользоваться при исследованиях отдельных атомов, молекул, электронов. Это объясняется тем, что для одной молекулы или для совокупности немногих молекул понятия теплоты и работы теряют смысл. В силу этого термодинамика не рассматривает микроскопический механизм явлений. Ей чужды модельные представления о структуре вещества и характере движения микроскопических частиц, которые входят в состав материального тела.
Остановимся кратко на характеристике некоторых основных положений и понятий термодинамики, с которыми в дальнейшем придется иметь дело.
Тело или совокупность взаимодействующих тел, мысленно обособленных от окружающей среды, называют в термодинамике системой. Остальная часть пространства со всем, что в ней находится, называется окружающей средой (или просто средой). По величине термодинамические системы могут быть самыми разнообразными: от булавочной головки (или меньше) до солнечной системы (или еще больше). Иными словами, система должна содержать достаточно большое число частиц (атомов, молекул, электронов), чтобы к ней были применимы такие понятия термодинамики, как теплота, температура, давление и т. п.
Система называется гомогенной, если внутри нее нет поверхностей раздела между частями системы, различающимися по свойствам (например, раствор каких-либо веществ или газ в замкнутом сосуде), и гетерогенной, если такие поверхности раздела имеются (например, кристаллы соли в насыщенном растворе).
Термодинамическая система называется неизолированной или незамкнутой, если она может получать или отдавать тепло в окружающую среду и производить работу, а внешняя среда — совершать работу над системой. Система является изолированной или замкнутой, если она не имеет обмена теплом с окружающей средой, а изменение давления внутри системы не влияет на окружающую среду и последняя не может произвести работу над системой.
Однородная часть системы с одинаковыми химическими и термодинамическими свойствами, отделенная от других частей видимой поверхностью раздела, при переходе через которую физические и химические свойства резко меняются, называется фазой. Наименьшее число составных частей системы, с помощью которых можно выразить состав любой ее фазы, называется компонентами системы.
Свойства любой термодинамической системы определяются ее параметрами или, как их еще называют, независимыми переменными. Все параметры системы подразделяются на две группы. Параметры, которые определяют свойства, зависящие от размеров системы (объем, масса, энтропия), относятся к одной группе. Другую составляют такие параметры, которые не зависят от размеров системы (температура, давление, потенциал, молярный или удельный объем). Свойства системы, определяемые параметрами первой группы, называют экстенсивными, а определяемые параметрами второй группы — интенсивными.
В качестве основных параметров системы выбирают такие, которые могут быть непосредственно измерены и выражают интенсивные свойства системы. Сюда относятся давление, температура и объем. Эти параметры могут быть связаны друг с другом уравнением состояния. Таким образом, термодинамическое состояние системы определяется совокупностью ее термодинамических параметров.
Состояние системы может быть равновесным и неравновесным. Если термодинамические параметры с течением времени не изменяются без каких-либо внешних воздействий на систему, такое состояние ее называется равновесным. Состояние системы будет неравновесным, если ее параметры изменяются при отсутствии воздействия.
Термодинамически равновесное состояние системы является в то же время истинным равновесием. Оно характеризуется тем, что бесконечно малые воздействия на систему вызывают бесконечно малые изменения в ней. Если это условие не выполняется, система находится в ложном (или неустойчивом) равновесии. В качестве примера систем, находящихся в состоянии ложного равновесия, можно назвать пересыщенные растворы, переохлажденные жидкости, переохлажденный пар при обычных условиях.
В каждой такой системе протекает односторонний процесс, посредством которого система стремится перейти из состояния ложного (неустойчивого) равновесия в истинное. Поэтому при малейшем воздействии на неустойчивую систему она за короткий промежуток времени перейдет в состояние истинного равновесия.
По этой причине любая изолированная система с течением времени переходит в термодинамически равновесное состояние и самопроизвольно выйти из этого состояния не может. Параметры равновесной системы могут иметь только строго определенные значения и, следовательно, к таким системам применимы любые уравнения состояния.
Переход термодинамической системы из одного состояния в другое называется в термодинамике процессом. При любом процессе одни параметры системы остаются неизменными, другие изменяются. В зависимости от того, какие параметры при переходе системы из одного состояния в другое остаются постоянными, процессы делятся на изохорические (при постоянном объеме), изобарические (при постоянном давлении), изотермические (при постоянной температуре) и т. д.
Любая термодинамическая система обладает определенным запасом энергии, которая в термодинамике носит название внутренней энергии. С позиции теории строения вещества внутренняя энергия складывается из энергии теплового движения частиц, а также из всех видов внутримолекулярной и внутриатомной энергии, за исключением кинетической и потенциальной энергии всего тела (системы). Она зависит от вида и массы рассматриваемого вещества, а также от его агрегатного состояния, и не зависит от того, каким способом оно приведено в это состояние. Обозначается внутренняя энергия буквой U. Она является экстенсивным свойством, так как зависит от количества рассматриваемого вещества.
Полную внутреннюю энергию системы определить невозможно, наука в настоящее время не располагает такими методами. Однако можно экспериментально определить изменение внутренней энергии системы при переходе ее из одного состояния в другое. Если обозначить через U1внутреннюю энергию системы в состоянии 1, U2 — ее внутреннюю энергию в состоянии 2, то изменение энергии в процессе перехода этой системы из состояния 1 в состояние 2 будет равно:

| 1.33 |
Здесь символ ∆ употребляется для обозначения разности, причем всегда из величины, относящейся к конечному состоянию системы, вычитается величина, относящаяся к начальному ее состоянию.
В изолированной системе сумма всех видов энергии является величиной постоянной, так как она не изменяется в результате взаимодействия частей, составляющих данную систему, т. е.
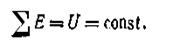
| 1.34 |
Здесь ∑ — знак суммирования, распространяющийся на все виды энергии, которая заключается в данной изолированной системе.
Очень важной характеристикой состояния термодинамической системы является энтальпия, обозначаемая символом Н. Как и внутренняя энергия, энтальпия является функцией состояния системы, и ее изменение в процессе не зависит от пути процесса, а лишь от начального и конечного состояний. С внутренней энергией, как будет показано в дальнейшем, она связана соотношением

| 1.35 |
где р — давление; V — объем рассматриваемой системы.
Абсолютное значение энтальпии не может быть вычислено с помощью уравнений термодинамики, так как она включает в себя абсолютную величину внутренней энергии. Поэтому на практике обычно определяют изменение энтальпии ∆Н системы:
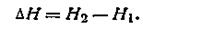
| 1.36 |
Как уже отмечалось, основными способами передачи энергии от одной части системы к другой являются теплота и работа. Определения теплоты и работы показывают, что эти понятия в термодинамике применимы только к процессам, но не к состояниям системы. Поэтому упрощенные выражения типа «система отдает работу (или теплоту)» носят условный характер; более строго следовало бы говорить «система отдает энергию в форме работы (или в форме теплоты)». Следует подчеркнуть, что термодинамическое понятие теплоты не отвечает обиходным представлениям о горячих и холодных телах как «содержащих больше или меньше теплоты».
В случае, когда энергия переходит от окружающей среды к системе, теплоту процесса принято считать положительной (Q>0). Процесс, сопровождающийся положительным тепловым эффектом, называют эндотермическим, а противоположный процесс (Q < 0) —экзотермическим.
Следует помнить, что в отличие от термодинамических систем в системах термохимических, наоборот, теплота, выделяемая в процессе химической реакции, положительная, а поглощаемая — отрицательная. Иными словами, в термохимии принято присваивать теплоте реакции знак, обратный тому, который используется в остальных разделах термодинамики. Во избежание путаницы в дальнейшем будем обозначать термохимические теплоты через Q.
Таким образом, Q= — Q.
Различают тепловой эффект процессов, осуществляющихся при постоянном объеме Qv(изохорный тепловой эффект), и тепловой эффект процессов, совершающихся при постоянном давлении Qp (изобарный тепловой эффект).
Работу принято считать положительной (W > 0), если система производит ее над окружающей средой. Работа определяется двумя величинами: фактором интенсивности и фактором емкости (экстенсивности). Если фактор интенсивности имеет постоянное значение, работа в данном процессе равна произведению фактора интенсивности на изменение фактора емкости.
Дата добавления: 2016-02-20; просмотров: 3175;
