Тепловые эффекты химических реакций
Раздел физической химии, изучающий тепловые изменения при химических реакциях, называется термохимией. Начальные основы термохимии впервые были заложены М. В. Ломоносовым. Было установлено, что все химические реакции сопровождаются поглощением или выделением тепловой энергии. Реакции, идущие с выделением теплоты, получили название экзотермических, а с поглощением теплоты — эндотермических. К реакциям первого типа относятся горение угля, спирта, метана, реакции нейтрализации. Примеры эндотермических реакций: разложение водяного пара, карбоната кальция, гидроксида меди, получение йодистого водорода, окиси азота из элементов.
Количество выделенной или поглощенной теплоты при той или иной химической реакции называется тепловым эффектом. Его обычно относят к молю реагирующего вещества и выражают в джоулях. В технике иногда тепловые эффекты относят к 1 кг вещества, а для газов — к 1 м3.
В химии при обозначении тепловых эффектов применяются знаки, обратные тем, которые используются в термодинамике. В термодинамике подводимая к системе теплота положительная, а теплота, которая выделяется,— отрицательная. В химии же, наоборот, тепловой эффект реакций, если они сопровождаются выделением теплоты, считается положительным, а если поглощением теплоты — отрицательным.
В термохимии принято химические процессы записывать в виде так называемых термохимических уравнений, в которых указывается тепловой эффект реакций. Например:

Из уравнений (а) и (б) следует, что в результате сгорания 1 моль водорода или метана выделяется соответственно 285,85 и 874,92 кДж теплоты. Уравнения (в) и (г) показывают, что при взаимодействии 1 моль воды с 1 моль углерода поглощается 129,70 кДжтеплоты, а при разложении 1 моль карбоната кальция поглощается 179,08 кДж теплоты.
То количество теплоты, которое выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ, в термохимии называют теплотой образования данного вещества. Теплота образования всегда относится к 1 моль вещества. Так, из уравнения реакции
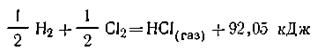
следует, что теплота образования 1 моль хлористого водорода равна + 92,05 кДж.
Количество теплоты, выделяемое или поглощаемое при разложении 1 моль сложного вещества на более простые соединения, называют теплотой разложения. Например, теплота разложения карбоната кальция равна —179,08 кДж.
В зависимости от природы растворителя и растворяемого вещества процесс растворения может сопровождаться выделением или поглощением теплоты. Количество теплоты, выделяющееся или поглощаемое при растворении 1 моль вещества, называют теплотой растворения. Теплота растворения зависит от относительных количеств растворителя и растворенного вещества.
Постоянство теплоты растворения наблюдается, когда на 1 моль растворенного вещества приходится более 300 моль растворителя. Таким образом, теплотой растворения называют количество теплоты, поглощающейся или выделяющейся при растворении 1 моль вещества в очень большом количестве растворителя, т. е. растворителя берут столько, чтобы при дальнейшем разбавлении раствора уже не наблюдалось добавочного теплового эффекта.
При растворении твердого вещества в воде (или каком-то другом растворителе) происходит разрушение кристаллической решетки, что, как известно, связано с затратой энергии. Одновременно с этим растворяемое вещество реагирует с растворителем (гидратация или сольватация), образуя соответственно гидраты или сольваты. Процессы гидратации и сольватации являются процессами экзотермическими. Поэтому теплота растворения складывается из двух слагаемых:
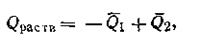
| 1.43 |
где Q1— теплота разрушения кристаллической решетки; Q2 — теплота гидратации или сольватации. Знак теплового эффекта Qpacтв зависит от того, какое из слагаемых больше по абсолютной величине. Если вещество обладает прочной кристаллической решеткой, в процессе растворения разрушение его кристаллической решетки будет проходить с поглощением большего количества теплоты, чем его выделяется в процессе гидратации, т. е. Q1> Q2. Теплота растворения в этом случае будет отрицательной. Наоборот, у веществ сильно гидратированных и с менее прочной кристаллической решеткой Q1< Q2.Тепловой эффект растворения в этом случае будет положительным.
Свойство веществ растворяться с выделением или поглощением теплоты довольно широко используется в технике. Так, вещества с высоким положительным тепловым эффектом используются в химических грелках, а вещества с отрицательным тепловым эффектом применяют для получения низких температур в холодильной промышленности в виде так называемых криогидратных смесей.
Опыт показывает, что, как правило, процесс нейтрализации сопровождается положительным тепловым эффектом. Процесс нейтрализации сводится к образованию электрически нейтральной молекулы воды за счет нейтрализации положительно заряженного иона Н+ отрицательно заряженным ионом ОН- . Было замечено, что нейтрализация сильной кислоты сильным основанием в водном растворе дает один и тот же тепловой эффект: около 57,32 кДж на грамм-эквивалент кислоты или основания (закон постоянства теплот нейтрализации). Например:
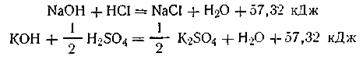
т. е. для обеих реакций
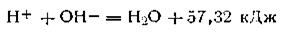
что более точно можно изобразить в виде
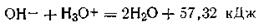
Таким образом, теплотой нейтрализации называется количество теплоты, которое выделяется при взаимодействии грамм-эквивалента кислоты с грамм-эквивалентом щелочи. Закон постоянства теплоты нейтрализации не соблюдается при нейтрализации слабых кислот слабыми основаниями: теплота нейтрализации в этих случаях бывает меньше, чем при взаимодействии сильных кислот и оснований. Это объясняется тем, что в реакциях слабых электролитов на тепловой эффект нейтрализации накладываются теплота диссоциации и другие явления.
При смешивании разбавленных растворов солей теплового эффекта не наблюдается. Так, при взаимодействии в растворе
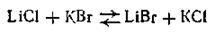
не наблюдается ни выделения, ни поглощения теплоты. Это явление (закон термонейтральности) было открыто Г. И. Гессом в 1841 г. и объясняется тем, что никаких существенных изменений с участвующими в процессе ионами (Li+, K+, С1- и Вг-) не происходит. Однако для необратимых процессов закон термонейтральности не выполняется. Например, в реакции
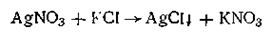
выпадает осадок и имеет место тепловой эффект реакции (теплота осаждения).
Еще одно важное для термохимии понятие — теплота сгорания. Теплота сгорания какого-либо вещества есть количество теплоты, которое выделяется при полном сгорании 1 моль вещества в токе кислорода. В частности, при сгорании органических веществ углерод окисляется до двуокиси углерода, водород — до воды и т. п. Например:
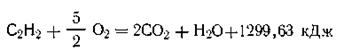
Теплота сгорания пищевых продуктов в живом организме является источником энергии,за счет которой осуществляется его жизнедеятельность.
Теплоты сгорания определяются сжиганием определенного количества вещества в специальном приборе — калориметрической бомбе. Она была сконструирована в свое время Бертло и позднее усовершенствована Малером .
Дата добавления: 2016-02-20; просмотров: 3321;
