Испарение и кипение жидкостей
Молекулы жидкости находятся в непрерывном движении. Однако не все они движутся с одинаковыми скоростями. Некоторая часть молекул обладает избыточным по сравнению со средним значением количеством энергии и имеет большую скорость. Эти молекулы, достигая поверхности жидкости, способны преодолеть силы притяжения остальных молекул и вылететь из жидкости. Жидкость испаряется. При движении молекул в направлении от поверхности жидкости скорость и кинетическая энергия их уменьшаются за счет преодоления сил притяжения со стороны молекул жидкости внутренних слоев.
Опыт показывает, что силы притяжения между молекулами жидкости при комнатной температуре в несколько раз превышают среднюю кинетическую энергию, которой обладают ее молекулы, при этой же температуре. По этой причине подавляющее большинство молекул не покидает жидкость, так как они не обладают для этого необходимым количеством энергии. Если бы силы притяжения между молекулами жидкости
 были много меньше, жидкость при комнатной температуре испарялась бы мгновенно, и вещество существовало бы не в жидком, а в газообразном агрегатном состоянии.
были много меньше, жидкость при комнатной температуре испарялась бы мгновенно, и вещество существовало бы не в жидком, а в газообразном агрегатном состоянии.
Процесс испарения сопровождается охлаждением, так как жидкость при испарении теряет наиболее быстрые («горячие») молекулы, а сами молекулы, преодолевая силы внутреннего притяжения, теряют значительное количество своей кинетической энергии. При нагревании же одновременно с увеличением средней скорости движения молекул жидкости происходит увеличение и числа молекул, покидающих жидкость: испарение увеличивается.
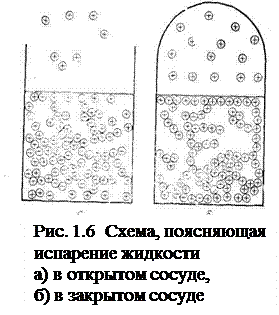
Испарение зависит также от давления и от общей поверхности испарения. Чем ниже давление и больше величина поверхности, тем интенсивнее идет процесс испарения. Если испарение происходит в закрытом сосуде, оно прекращается, когда давление пара достигает некоторой определенной величины, характерной для каждой жидкости и температуры. Над жидкостью в этом случае устанавливается постоянная концентрация пара. Пар, находящийся в равновесии с жидкостью, называется насыщенным, а давление, которое он производит,— давлением насыщенного пара (рис. 1.6).
Таким образом, при постоянной температуре давление насыщенного пара данного вещества является величиной постоянной и характерной для него. При повышении температуры давление насыщенного пара увеличивается.
Переход вещества из жидкого состояния в парообразное называется парообразованием. Различают две формы этого процесса: испарение и кипение. В первом случае парообразование происходит только со свободной поверхности жидкости. Во втором — не только с поверхности, но и во всем объеме жидкости путем образования пузырьков пара и выделения их. Давление насыщенного пара при этом равно внешнему давлению. Температура, при которой происходит этот процесс, называется температурой кипения.
Температура кипения жидкости изменяется с изменением внешнего давления. Если уменьшить последнее, то давление пара над жидкостью сравняется с внешним давлением при меньших значениях температуры, т. е. жидкость в данном случае будет кипеть при более низкой температуре. Подобное явление можно наблюдать в горах, где давление воздуха значительно ниже нормального атмосферного давления.
Количество теплоты, которое поглощается единицей массы вещества при изотермическом испарении, называют теплотой испарения. Различают удельную теплоту испарения (отнесенную к одному килограмму вещества) и молярную теплоту испарения (т. е. теплоту испарения одного моля).

| 1.32 |
Дата добавления: 2016-02-20; просмотров: 1883;
