Основные газовые законы.
Сила взаимодействия между молекулами, как известно, зависит от расстояния между ними. Силы межмолекулярного взаимодействия (так называемые силы когезии) за пределами расстояния, большего 10-7 см от центра молекулы, настолько ослабевают, что ими можно пренебречь.
Средней кинетической энергии теплового движения молекул газа вполне достаточно, чтобы преодолеть силы когезии (силы межмолекулярного взаимодействия). При столкновении молекул друг с другом, когда одна молекула попадает в силовое поле притяжения другой молекулы, между ними возникает мгновенное когезионное взаимодействие.
Чем больше давление, тем больше число столкновений молекул газа в 1 с, а следовательно, и суммарные мгновенные когезионные взаимодействия между ними оказывают большее влияние на свойства данного газа. И наоборот, в состоянии сильного разрежения размеры молекул по сравнению с межмолекулярными расстояниями и силы взаимодействия между молекулами ничтожны.
В силу хаотического движения молекул газа концентрация их в любой части занимаемого газом пространства одинакова, как и плотность его во всей массе.
Однако это справедливо лишь в том случае, если речь идет о средней плотности газа в макрообъеме. В микрообъеме же вследствие хаотичности молекулярного движения могут происходить значительные отклонения от средней плотности. Это явление называется флуктуацией (лат. fluctuatio — колебание). Флуктуационные отклонения плотности тем больше, чем меньше микрообъем. В отдельных случаях они могут достигать 20% и более по сравнению со средней плотностью газа во всей его массе.
Газы широко распространены в природе и используются в различных отраслях народного хозяйства в качестве топлива, теплоносителей, сырья для химической промышленности, рабочего тела для выполнения механической работы (газовые турбины) и во многих других случаях. Отсюда вытекает необходимость знания законов, которым подчиняются газы.
Основные газовые законы выведены для идеального газа. Идеальным называется газ, находящийся в таком состоянии, при котором можно пренебречь силами межмолекулярного взаимодействия и собственным объемом его молекул.
Свойства идеального газа, таким образом, определяются температурой и давлением, при которых газ находится в данный момент.
Газы, реально существующие в природе (реальные газы), в большей или меньшей степени отступают от газовых законов.
Закон Бойля-Мариотта. Объем данной массы газа (V) при постоянной температуре изменяется обратно пропорционально давлению (р), под которым газ находится:

| 1.1 |
или p1V1 = p2V2. Аналогичное равенство можно написать и для других значений р и V:
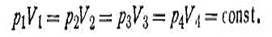
| 1.2 |
Отбросив индексы, получим:

| 1.3 |
при условии, что t = const.
Таким образом, произведение объема газа на его давление при постоянной температуре есть величина постоянная. Величина константы в уравнении (1.2) зависит от природы газа, его количества и температуры, но не зависит от изменения объема или изменения давления.
Из закона Бойля-Мариотта вытекает следующее: концентрация и плотность данной массы газа изменяются при постоянной температуре прямо пропорционально изменению давления и обратно пропорционально изменению объема.
Таким образом, исходя из уравнения (1.1) можно записать:
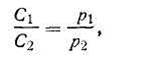 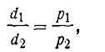
| 1.4 |
 где С1, С2 и d1,d2 - соответственно концентрации и плотности данной массы газа.
где С1, С2 и d1,d2 - соответственно концентрации и плотности данной массы газа.
Закон Гей-Люссака. При нагревании данной массы газа на 1 К при постоянном давлении объем его увеличивается на 1/273,16 часть того объема, каким обладал бы газ при 273,16 К и при том же давлении. Так, если объем газа при 273,16 К был V0, при нагревании газа на ∆T градусов стал Vт, а прирост объема ∆V, то
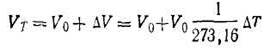
| 1.5 |
Или
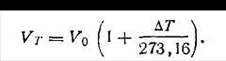
| 1.6 |
В уравнении (1.6) величина 1/273,16 =a, носит название коэффициента термического расширения. Этот коэффициент не зависит от природы идеального газа, его давления, объема и температуры. Таким образом,
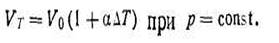
| 1.7 |
Если объем газа остается постоянным, то по такому же закону растет и давление:
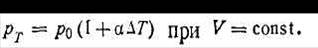
| 1.8 |
В этом случае величина a, равная 1/273,16, называется термическим коэффициентом упругости газа.
Математическую зависимость, выражающую закон Гей-Люссака, можно значительно упростить, если в уравнение (1.5) вместо ∆Т ввести Т.
Учитывая, что

| 1.9 |
преобразуем уравнение (1.5) следующим образом:
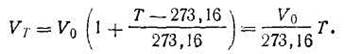
| 1.10 |
Отбросив индексы и объединив постоянные величины в одну константу, получим V = const T при р = const. Аналогично можно преобразовать и уравнение (1.8), получив р = const Т при V = const.
На основании приведенных уравнений можно сделать вывод: объем и давление изменяются прямо пропорционально изменению термодинамической температуры газа:
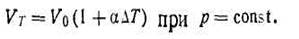
| 1.11 |
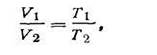
| 1.12 |
Графически закон Гей-Люссака выражается пучком прямых линий, выходящих из начала координат.
Из закона Гей-Люссака вытекает: плотность и концентрация газа, находящегося под постоянным давлением, обратно пропорциональны термодинамическим температурам
 
| 1.13 |
Закон Авогадро. В равных объемах различных газов при одинаковой температуре и давлении содержится одинаковое число частиц (молекул или атомов).
Из закона Авогадро вытекает важное следствие. Число молекул, которое содержится в одном киломоле любого газа, есть величина постоянная: N0= 6,02·1026 (постоянная Авогадро).
Полезно отметить, что термин кмоль определяется как 6,02·1026 «формульных единиц» (не обязательно молекул!). Следовательно, при одинаковых условиях 1 кмоль любого газообразного вещества должен занимать постоянный объем. Так, при нормальных условиях (T = 273,16 К; р= 101 325 Па) 1 кмоль любого газа занимает объем 22,4 м3. Этой величиной часто пользуются в расчетах.
Состояние газа характеризуется тремя величинами: давлением р, объемом V и температурой Т. Эти три величины связаны уравнением, которое получило название уравнения состояния идеального газа.
Оно выводится путем объединения законов Бойля-Мариотта, Гей-Люссака и Авогадро. Если 1 кмоль газа при нормальных условиях (р0, Т0 и V0) нагреть до определенной температуры Т при том же давлении, то согласно закону Гей-Люссака объем газа при этой температуре VT будет равен:
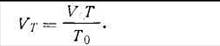
| 1.14 |
Если при постоянной температуре Т изменить давление газа от р0 до любого значения р, то объем газа также изменится и станет равным V. На основании закона Бойля-Мариотта pV = p0VТ.
Подставив в это уравнение значение VТ (I.11),
получим pV = Tp0V0 /T0, откуда
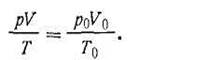
| 1.15 |
Поскольку p0, V0 и Т0 — величины постоянные, отношение PoVo/To есть также величина постоянная для всех газов независимо от их химической природы. Эту постоянную величину обозначают буквой R и называют универсальной газовой постоянной. С учетом этого уравнение (I.15) преобразится:
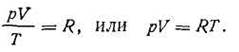
| 1.16 |
Уравнение (I.16) справедливо для 1 кмоль газа. Если в объеме газа будет содержаться n кмоль, то это уравнение будет иметь более общий вид:
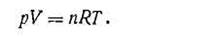
| 1.17 |
Уравнение (I.17) является основным уравнением газового состояния и называется уравнением Клапейрона - Менделеева. Впервые это уравнение было выведено Клапейроном в 1834 г. Д. И. Менделеев в своих работах в 1874 г. указал, что благодаря закону Авогадро уравнение Клапейрона приобретает наибольшую общность, когда оно относится не к обычной единице массы (грамму или килограмму), а к 1 кмоль газа.
Число киломолей газа n можно рассчитать по формуле
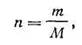
| 1.18 |
где m — масса газа, содержащегося в объеме V при давлении р и температуре Т ; М — масса киломоля газа.
Подставив значение n в уравнение (I.17), получим
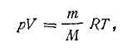
| 1.19 |
Откуда
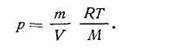
| 1.20 |
Отношение m/V есть не что иное, как плотность газа d, откуда d = Mp/RT. Если обе части уравнения (I.20) разделить на объем V, получим
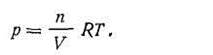
| 1.21 |
Поскольку отношение n/V есть концентрация газа С, то уравнение Клапейрона - Менделеева будет иметь вид:
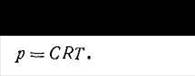
| 1.22 |
Численное значение универсальной газовой постоянной зависит от того, в каких единицах измерены нормальное давление р0 и объем V0 одного моля таза.
Дата добавления: 2016-02-20; просмотров: 2396;
