Газовые смеси. Закон Дальтона.
В практике очень часто приходится иметь дело не с чистыми газами, а с их смесями. Особенно широкое распространение газовые смеси получили в технике. Одни из них служат ценным химическим сырьем и используются при синтезе ряда веществ (нефтяные газы, воздух), другие являются хорошим газообразным топливом (природный, доменный, генераторный газы).
Основным законом газовых смесей является закон Дальтона, который имеет следующую формулировку: общее давление газовой смеси робщ равно сумме парциальных давлений всех входящих в нее газов р1+р2 + p3 + ..., т. е.
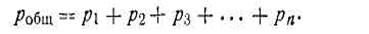
| 1.27 |
Парциальное давление — это часть общего давления в газовой смеси. Оно равно тому давлению газа, которым он обладал бы, занимая один весь объем смеси.
Как и другие законы идеальных газов, закон Дальтона не выполняется при высоких давлениях и низких температурах.
К каждому отдельному газу, входящему в данную газовую смесь, может быть применено уравнение состояния газа (I.17):
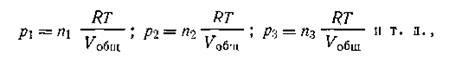
| 1.28 |
где Vобщ — общий объем газовой смеси; n1, n2, n3 ,... — числа молей отдельных газов в смеси.
Подставив эти выражения в (I.27) и сделав соответствующие преобразования, получим уравнение состояния применительно к смесям идеальных газов:
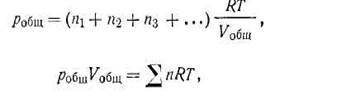
| 1.29 |
где ∑n — сумма числа молей газов в смеси.
Помимо парциального давления для газовых смесей различают парциальный объем каждого из газов: υ1, υ2, υ3 и т. д. Парциальный объем — это объем, который занимал бы отдельный газ, входящий в состав смеси идеальных газов, если бы при том же количестве он имел давление и температуру смеси.
Сумма парциальных объемов всех идеальных газов, входящих в смесь, равна общему объему смеси:
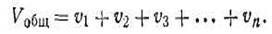
Состав газовых смесей обычно выражают в массовых и объемных долях в процентах, а также в молярных долях и молярных долях в процентах. Выражение состава газовых смесей в объемных долях в процентах широко применяется в газовом анализе.
Дата добавления: 2016-02-20; просмотров: 4883;
