Отступление от законов Вант-Гоффа и Рауля в растворах электролитов. Теория электролитической диссоциации.
Законы Вант-Гоффа и Рауля справедливы для идеальных растворов, т. е. таких, в которых нет химического взаимодействия между компонентами раствора, а также диссоциации или ассоциации молекул растворенного вещества. Опыт показал, что у растворов, проводящих электрический ток (электролиты), более высокое, чем по закону Вант-Гоффа, осмотическое давление, они кипят при более высокой температуре и замерзают при более низкой, чем это следует из закона Рауля. Такими свойствами обладают растворы солей, кислот и оснований.
Обобщая наблюдения, Вант-Гофф пришел к выводу, что в отношении осмотического давления растворы электролитов ведут себя так, как будто они содержат больше частиц, чем это следует из аналитической концентрации. Исходя из этого, Вант-Гофф внес в уравнение (4.4) для растворов электролитов поправку, получившую название коэффициента Вант-Гоффа или изотонического коэффициента(i)
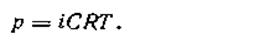
| 4.13 |
Изотонический коэффициент показывает, во сколько раз наблюдаемое осмотическое давление (роп) раствора больше теоретически вычисленного (рвыч) для раствора неэлектролита, т. е.
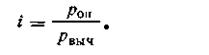
| 4.14 |
Отсюда следует:
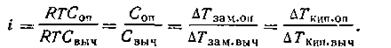
| 4.15 |
Таким образом, коэффициент i можно найти, если измерить непосредственно осмотическое давление с помощью осмометра Пфеффера или криоскопическим методом, что значительно проще. Коэффициент Вант-Гоффа для неэлектролитов, растворенных в воде, равен 1, а для электролитов он больше единицы. Значение коэффициента растет по мере разбавления электролита. Для растворов, в которых имеет место ассоциация молекул растворенного вещества, коэффициент i бывает меньше единицы.
Причину отклонения от законов ВантТоффа и Рауля в растворах электролитов впервые разъяснил шведский ученый С. Аррениус (1883—1887) в своей теории электролитической диссоциации. Она основывалась на трех постулатах.
1.Электролиты обладают способностью при растворении в соответствующих растворителях (например, в воде, к которой первоначально и относилась теория Аррениуса) диссоциировать на противоположно заряженные частицы — ионы. При этом молекулы кислот распадаются на положительные ионы водорода и отрицательные ионы кислотного остатка:
H2SO4 = 2Н+ + SO42-
молекулы оснований — на положительные ионы металла и отрицательные гидроксид-ионы:
КОН = К+ + ОН-
соли (средние)—на положительные ионы металла и отрицательные ионы кислотного остатка:
KCI = К+ + CI-
кислые и основные соли, помимо ионов металла и кислотного остатка, дают также в растворе ионы водорода или гидроксидионы:
КН2РО4 = К+ + 2Н+ + РО43- ; Аl(ОН)SO4 = Аl3+ + SO4- + ОН-
Таким образом, электролиты при растворении в воде распадаются на ионы, за счет чего увеличивается число частиц. Это увеличение числа частиц и влияет на осмотическое давление и температуры кипения и замерзания растворов, т. е. свойства электролитов определяются суммой концентраций частиц — ионов и недиссоциированных молекул.
2.Электролиты при растворении диссоциируют на ионы не полностью. В состоянии равновесия доля молекул, распавшихся на ионы, количественно характеризуется степенью электролитической диссоциации и обозначается через а.
Степень электролитической диссоциации равна отношению числа молекул п, распавшихся на ионы, к общему числу растворенных молекул N (ионизированных п и неионизированных па):
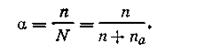
| 4.16 |
Величина степени электролитической диссоциации зависит от природы растворенного вещества и растворителя, а также от концентрации и температуры раствора. Если вещество не диссоциирует при растворении (п = 0, na = N, a= 0), оно не электролит. Если а близка к единице, то п ~ N и соединение — сильный электролит. Для многих химических соединений 0 < а < 1, а следовательно, п ≤ N, т. е. они слабые электролиты.
По способности к диссоциации Аррениус разделил все электролиты на три группы: сильные электролиты (а>30%), электролиты средней силы (а = 5—30%), слабые электролиты (а<5%). К сильным электролитам были отнесены: соляная, бромистоводородная, иодистоводородная, азотная, серная, марганцовая кислоты; гидроксиды натрия, калия, бария, а также большинство солей. Согласно теории Аррениуса для сильных электролитов характерна значительная диссоциация и, следовательно, хорошая электрическая проводимость.
К слабым электролитам относятся почти все органические кислоты (муравьиная, уксусная, бензойная), цианистоводородная кислота, борная кислота, угольная кислота, сероводородная кислота, гидроксид аммония, вода, а также некоторые соли (HgCl2, CdCl2). Для растворов слабых электролитов характерна очень небольшая величина электрической проводимости.
К электролитам средней силы относятся фосфорная, мышьяковая, йодная, хромовая, сернистая кислоты и целый ряд других соединений.
3.Силы взаимодействия между ионами отсутствуют и растворы электролитов ведут себя подобно идеальным газовым системам. Это положение автором теории электролитической диссоциации и его последователями прямо не высказано, но на нем основаны ее количественные соотношения.
При помощи трех постулатов теория электролитической диссоциации объяснила многие свойства растворов, дала их количественную характеристику и истолковала многочисленные факты и закономерности.
В своих работах Аррениус показал, что степень диссоциации электролита а можно связать с коэффициентом Вант-Гоффа i. Приведем простейший вывод этих соотношений. Предположим, что в растворе находилось N молекул электролита, из которых только п продиссоциировало на ионы. Число непродиссоциированных молекул N— п, а число образовавшихся ионов νn, где ν — число ионов, на которое диссоциирует одна молекула электролита. Тогда число всех частиц в растворе, включая и молекулы, и ионы, (N — п) + νп, или после соответствующего преобразования
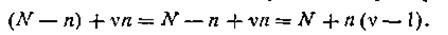
| 4.17 |
Таким образом, мы нашли общее число частиц в растворе электролита. Если бы у нас был раствор неэлектролита, то число частиц осталось бы равным N. Осмотическое давление, как уже отмечалось, пропорционально числу частиц. Следовательно, наблюдаемое осмотическое давление роппропорционально общему числу частиц N + n(v— 1), теоретическое же рвыч пропорционально N. Исходя из этого, можем записать:
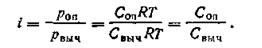
| 4.18 |
После подстановки в уравнение (4.18) значений N и N + п(ν— 1) получим
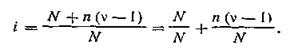
| 4.19 |
В этом уравнении выражение n/N есть не что иное, как степень диссоциации а. После замены выражение (4.19) примет вид
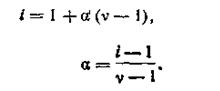
| 4.20 |
Поскольку i = ∆Топ/∆Твыч, то, подставив это выражение в уравнение (IV, 8), получим формулу для вычисления степени электролитической диссоциации криоскопическим методом:
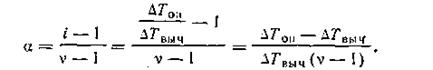
| 4.21 |
Из всего вышеизложенного можно сделать следующие выводы.
1. Растворы электролитов изотоничные, если при одинаковой температуре они содержат одинаковое число частиц (молекулы + ионы) в единице объема.
2. Из двух растворов с одинаковой молярной концентрацией осмотическое давление выше в растворе электролита с более высокой степенью диссоциации а.
3. Из двух растворов с одинаковой молярной концентрацией и степенью диссоциации а осмотическое давление выше в растворе электролита, диссоциирующего на большее число ионов.
Теория электролитической диссоциации Аррениуса дала возможность объяснить не только причины отклонения растворов электролитов от законов Вант-Гоффа и Рауля, но и объяснить многие особенности химических свойств электролитов (реакции гидролиза, значение концентрации водородных ионов и др.). Однако она имела и ряд недостатков, в частности не учитывала взаимодействия между ионами в растворе, вызываемого их электрическими зарядами.
И. А. Каблуков (1891), основываясь на гидратной теории растворов Д. И. Менделеева, считал, что нельзя рассматривать раствор как систему, в которой отсутствует взаимодействие частиц растворителя и растворенного вещества. На основании громадного числа фактов было установлено, что теория электролитической диссоциации приложима только к разбавленным растворам слабых электролитов. Поведение концентрированных растворов слабых электролитов, а также растворов сильных электролитов любых концентраций нельзя описать количественно на основании теории Аррениуса. Главный недостаток теории электролитической диссоциации, и вместе с тем причина всех ее недостатков, заключается в игнорировании взаимодействия частиц растворенного вещества между собой, а также с молекулами растворителя. Все эти противоречия были в дальнейшем в значительной степени устранены в так называемой теории сильных электролитов.

Дата добавления: 2016-02-20; просмотров: 5146;
