Электрическая проводимость растворов. Удельная электрическая проводимость.
Под прохождением электрического тока через вещество понимают движение (перенос) электрических зарядов от одного полюса к другому под действием внешнего электрического поля. Способность вещества проводить электрический ток называется электрической проводимостью.
Различают две основные формы проводимости: электронную и ионную. Электронной проводимостью обладают, например, металлы в твердом и расплавленном состоянии. Электрический ток по этим проводникам передается потоком электронов аналогично потоку газов в трубе в направлении от катода цепи к аноду.
В растворах электролитов перенос электричества осуществляется за счет перемещения ионов. Анионы в электрическом поле движутся к положительно заряженному электроду — аноду, катионы — к отрицательному электроду — катоду. Скорость движения ионов в растворах по сравнению со скоростями движения электронов в металлах мала, поэтому электрическая проводимость, например, меди и серебра примерно в 1 000 000 раз больше проводимости растворов.
Проводник, по которому течет электрический ток, представляет для него определенное сопротивление. За единицу сопротивления, как известно, принят Ом, который представляет собой сопротивление проводника, между концами которого при силе тока 1 А возникает напряжение 1 В.
Согласно закону Ома сопротивление R прямо пропорционально длине проводника l, обратно пропорционально площади сечения S и зависит от материала:

| 4.26 |
В этом уравнении ρ (греч. «ро» — удельное сопротивление, т. е. сопротивление проводника, имеющего длину 1 м и сечение 1 м2 (при Т = const), которое зави-
сит исключительно от качества материала.
Значения удельных сопротивлений приведены для одной и той же температуры, поскольку сопротивление проводников зависит от температуры. Эта зависимость для металлов и электролитов противоположна: если сопротивление металлов с повышением температуры увеличивается, то сопротивление растворов электролитов, наоборот, уменьшается (примерно на 1—2,5% на каждый градус).
Когда речь идет о растворах электролитов, обычно говорят не о сопротивлении растворов, а об их электрической проводимости. Мерой электрической проводимости является количество электричества, выраженное в кулонах, которое за единицу времени проходит через электролит. Таким образом, для растворов электролитов справедливо следующее соотношение:

| 4.27 |
где I — сила тока; Е — электродвижущая сила (э. д. с); L — электрическая проводимость электролита. В том случае, когда Е = 1 В, I = L; L, как и I, есть сила тока, измеряемая в амперах.
Из курса физики известно, что

| 4.28 |
где I — сила тока; Е — э. д. с, R — сопротивление. Подставив значение I из уравнения (4.27) в уравнение (4.28), получим
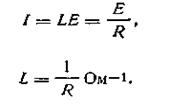
| 4.29 |
Таким образом, электрическую проводимость раствора можно характеризовать как величину, обратную его сопротивлению. Подставив в уравнение (4.29) значение R из закона Ома будем иметь
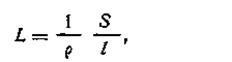
| 4.30 |
где 1/р — величина, обратная удельному сопротивлению, называемая удельной электрической проводимостью. Обозначается она буквой χ (греч. «каппа»). Уравнение (4.30) примет вид

| 4.31 |
Если S = 1 м2, а l= 1 м, то L = χ.
Удельная электрическая проводимость электролита у, представляет собой величину, обратную сопротивлению столба раствора длиной 1 м и площадью сечения 1 м2. В системе СИ единицей электрической проводимости является сименс (обозначаемый сокращенно См), равный электрической проводимости проводника, имеющего сопротивление 1 Ом. Названа в честь Э. В. Сименса. Таким образом, удельную электрическую проводимость растворов определяют в См ∙м-1.
Поскольку в растворах электролитов при прохождении электричества ионы перемещаются между электродами и отдают свой заряд только на их поверхности, то в приведенной формуле S обозначает площадь, l — расстояние между электродами.
Например, удельное сопротивление некоторого образца воды при 291 К ρ = 2·108 См·м-1. Удельная электрическая проводимость этого образца воды

Удельная проводимость растворов электролитов зависит также от индивидуальных свойств ионов. Дело в том, что количество переносимого ионами электрического тока в растворе электролита зависит не только от числа ионов в единице объема, но и от скорости их движения.
Известно, что различные ионы движутся в электрическом поле с неодинаковой скоростью. В табл. 4.5 приведены значения скорости движения некоторых ионов, отнесенные к падению потенциала 1 В/м (абсолютные скорости движения ионов).
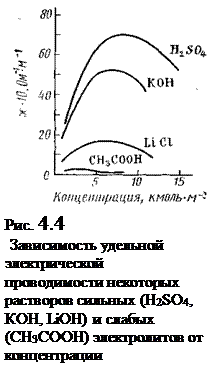 Как видно из табл. 4.5, скорости движения ионов при прохождении электрического тока в общем очень малы по сравнению со скоростями движения молекул в газах. Так, ион водорода в водной среде движется приблизительно в сто миллионов раз медленнее, чем молекула Н2 в газообразной среде. Объясняется это тем, что ионы в воде гидратированы и при движении испытывают огромное сопротивление со стороны среды (растворителя). Из данных табл. 4.5 видно, что ионы Н+ и ОН- обладают по сравнению со всеми другими ионами наибольшими абсолютными скоростями, что нельзя объяснить только малым радиусом ионов Н+ и ОН-. Радиус ОН- -иона (1,4·102 нм) соизмерим с радиусами других ионов, ион Н+ в водных растворах существует лишь в виде иона гидроксония Н3О+, радиус которого также сравним с радиусами многих ионов.
Как видно из табл. 4.5, скорости движения ионов при прохождении электрического тока в общем очень малы по сравнению со скоростями движения молекул в газах. Так, ион водорода в водной среде движется приблизительно в сто миллионов раз медленнее, чем молекула Н2 в газообразной среде. Объясняется это тем, что ионы в воде гидратированы и при движении испытывают огромное сопротивление со стороны среды (растворителя). Из данных табл. 4.5 видно, что ионы Н+ и ОН- обладают по сравнению со всеми другими ионами наибольшими абсолютными скоростями, что нельзя объяснить только малым радиусом ионов Н+ и ОН-. Радиус ОН- -иона (1,4·102 нм) соизмерим с радиусами других ионов, ион Н+ в водных растворах существует лишь в виде иона гидроксония Н3О+, радиус которого также сравним с радиусами многих ионов.
|

Вполне понятно, что при таком механизме проводимости скорость иона водорода значительно больше, чем других ионов. Совершенно аналогичным переходом протона от молекулы воды к иону ОН- объясняется кажущееся движение гидроксид-ионов в обратном направлении. Поскольку отрыв протона от молекулы воды происходит с большим трудом, чем его переход от гидроксоний-иона, подвижность ОН-иона несколько меньше, чем подвижность ионов водорода. Именно этим и объясняется значительно большая электрическая проводимость водных растворов кислот и оснований, чем растворов солей при одинаковых концентрациях.
Электрическая проводимость растворов зависит также и от заряда ионов: чем он выше, тем большее количество электричества переносит ион с одного электрода на другой. Так, каждый двухзарядный анион отдает аноду два электрона, а однозарядный — только один. Удельная проводимость растворов зависит также от температуры. Эта зависимость довольно сложная. При повышении температуры скорость движения ионов возрастает в связи с уменьшением вязкости среды. Кроме того, изменение температуры влияет на
 степень электролитической диссоциации электролита и тем самым на проводимость раствора. Повышение температуры на 1° ведет к ускорению движения ионов, а следовательно, к возрастанию проводимости раствора на 1,5—2,7%.
степень электролитической диссоциации электролита и тем самым на проводимость раствора. Повышение температуры на 1° ведет к ускорению движения ионов, а следовательно, к возрастанию проводимости раствора на 1,5—2,7%.
Поскольку удельная электрическая проводимость зависит от многих факторов, на основе ее изучения не представляется возможным сделать какие-либо выводы общего характера. Поэтому для удобства учета влияния на проводимость растворов электролитов их концентрации и взаимодействия между ионами Ленц ввел понятие об эквивалентной электрической проводимости.
Дата добавления: 2016-02-20; просмотров: 1754;
