ИЗОЭЛЕКТРИЧЕСКАЯ ТОЧКА ПОЛИАМФОЛИТОВ
Белки относятся к полиамфолитам,т.е. к веществам, способным в
зависимости от условий проявлять свойства как оснований, так и кислот. Остатки ионогенных аминокислот (аспарагиновой и глутаминовой кислот, аргинина, лизина и гистидина) могут находиться как в протонированной, так и в депротонированной формах. Состояние, при котором суммарный заряд полиамфолита равен нулю, называется изоэлектрическим. Значение pH раствора, соответствующее изоэлектрическому состоянию, называется изоэлектрической точкой (pi). В среде с большей кислотностью, чем в изоэлектрической точке (pH < pi), ионизация карбоксильных групп подавлена, вследствие чего белок находится в форме макрокатионов, положительный заряд которых обусловлен наличием –R–NH3+-групп. В среде с меньшей кислотностью, чем в изоэлектрической точке (pH > pi), карбоксильные группы депротонированы, вследствие чего белок находится в форме макроанионов, отрицательный заряд которых обусловлен наличием –R–СОО--групп.
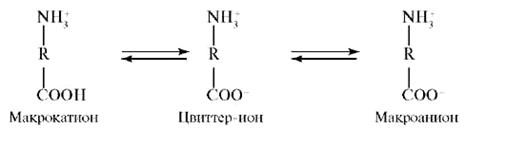
Возникновение электрического заряда в состоянии, отличающемся от изоэлектрического, обусловливает электрофоретическую подвижность белков. Направление движения макромолекул белков в электрическом поле (к катоду или аноду) зависит от значения pH. Белки, как и все амфолиты, имеют определенную величину изоэлектрической точки. В таблице 2 приведены значения изоэлектрических точек некоторых наиболее распространенных белков.
Таблица 2– Изоэлектрические точки некоторых белков
| Белок | ИЭТ |
| Пепсин желудочного сока | 2,00 |
| Казеин молока | 4,60 |
| Яичный альбумин | 4,71 |
| γ-Глобулин крови | 6,40 |
| Фибриноген крови | 5,40 |
| Гемоглобин | 6,68 |
| Химотрипсин сока поджелудочной железы | 8,60 |
| Рибонуклеаза | 9,50 |
| Цитохром С | 10,70 |
При pH < pi протонируются основные группы в боковых цепях; белок находится в форме макрокатиона и перемещается к катоду. При pH = pi белок находится в электронейтральной форме (макромолекула) и в электрическом поле не перемещается. При pH > pi белок перемещается к аноду, так как находится в форме макроаниона вследствие депротонирования кислотных групп в боковых цепях. Макроанионы различаются электрофоретической подвижностью, которая зависит от размера иона и его заряда.
Описанные закономерности используются в электрофоретическом методе анализа белков. С помощью электрофореза можно разделить на отдельные фракции сложные смеси белков.
В изоэлектрическом состоянии свойства растворов белков резко меняются: при этом они имеют, например, наименьшую вязкость, плохую растворимость, что связано с изменением формы макромолекул. При значении рН, близком к изоэлектрической точке, разноименно заряженные группы –NH3+ и –СОО- притягиваются друг к другу и нить закручивается в спираль. При смещении рН среды от изоэлектрической точки одноименно заряженные группы отталкиваются и цепь выпрямляется. Молекулы ВМС в развернутом состоянии придают растворам более высокую вязкость, чем молекулы ВМС, свернутые в спираль или клубок.
Дата добавления: 2016-04-22; просмотров: 6608;
