Применение методов криоскопии и эбулиоскопии.
Измерение понижения температуры замерзания или кипения раствора позволяет решать целый ряд вопросов, касающихся свойств данного раствора и растворенного вещества. Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопическим методом, а метод, основанный на измерении температуры повышения кипения растворов, получил название эбулиоскопического метода.
Для более точного измерения температуры замерзания или кипения раствора обычно применяют дифференциальный термометр Бекмана, который имеет шкалу, разделенную на 5—6 градусов. . С помощью такого термометра можно определять разность температур в широком интервале, а также температуры замерзания и кипения различных растворов.
В лабораторной практике криоскопический метод нашел значительно большее распространение по сравнению с методом эбулиоскопии: измерять точки замерзания растворов при этом значительно проще и безопаснее, чем точки кипения их.
Определение молекулярной массы вещества. Криоскопическим методом часто пользуются при определении молекулярной массы вещества.
Решая выражение (4.8) относительно М, получим окончательную формулу для вычисления молекулярной массы криоскопическим методом.
Например, водный раствор сахара, содержащий 17·10-5 кг сахара в 25·10-3 кг воды, замерзает при температуре 273,123 К. Определить молекулярную массу сахара. Подставив данные в формулу (4.8), получим
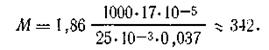
(В данном случае T=273,160—273,123 = 0,037 К.)
Определение осмотического давления растворов.Опыт показывает, что измерение осмотического давления с помощью осмометра Пфеффера связано с целым рядом трудностей. Это измерение слишком длительно и не совсем точно, так как на практике трудно подобрать подходящую мембрану, которая бы обладала идеальной полупроницаемостью. Осмотическое давление обычно измеряется косвенным путем, например методом криоскопии.
В основе этого определения лежат законы Вант-Гоффа и Рауля, т. е. П = RTC ∆Т = Кт, где С — концентрация раствора (в моль/л раствора); т— концентрация раствора (в моль на 1 кг растворителя). Для разбавленных растворов можно без большой погрешности принять, что т= С. Подставив в уравнение закона Вант-Гоффа вместо С равное значение ∆T/K из закона Рауля, найдем
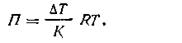
| 4.11 |
После замены буквенных выражений R, Т и К их численными значениями (для разбавленных растворов) получим окончательное уравнение для вычисления осмотического давления криоскопическим методом:
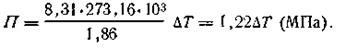
Определение концентрации раствора.На основании второго закона Рауля можно сравнительно легко вычислять моляльную концентрацию раствора, если известно понижение его температуры замерзания:
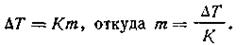
| 4.12 |
Таким способом можно определять концентрацию клеточного сока растений и концентрацию почвенного раствора. Необходимо помнить, что найденные этим методом концентрации являются суммарными, т. е. показывают содержание всех веществ, находящихся в растворе, выраженное в моль на 1 кг воды.
С помощью метода криоскопии можно определять осмотический коэффициент Вант-Гоффа и степень электролитической диссоциации слабых электролитов.
Дата добавления: 2016-02-20; просмотров: 5315;
