Температуры замерзания и кипения разбавленных растворов
Опыт показывает, что температура замерзания и кипения растворов зависит от давления пара над ними. Еще М. В. Ломоносов обнаружил, что растворы замерзают при более низкой и кипят при более высокой температуре, чем чистые растворители. Понижение температуры замерзания раствора связано с понижением давления (упругости) пара растворителя над раствором.
Как известно, жидкость закипает при той температуре, при которой давление ее насыщенного пара становится равным атмосферному давлению. Так, очищенная вода при атмосферном давлении замерзает при температуре 273,16 К и кипит при 373,16 К. Стоит растворить в воде какое-либо вещество, как давление ее пара понизится. Чтобы раствор закипел, необходимо нагреть его до температуры выше 373,16 К, ибо только при более высокой температуре давление пара станет равным атмосферному давлению. Чем больше концентрация растворенного вещества, тем при более высокой температуре будет кипеть раствор.
Температура замерзания растворов также отличается от температуры замерзания чистых растворителей. Известно, что жидкость замерзает при той температуре, при которой давление пара вещества в твердом состоянии становится равным давлению пара этого же вещества в жидком состоянии. Например, при 273,16К давление пара льда (613,3 Па) равно давлению пара воды. Лед и вода могут одновременно сосуществовать друг с другом при температуре, которая носит название температуры замерзания.
Если взять какой-то водный раствор, то вследствие понижения давления пара при 273,16 К он будет обладать меньшим, чем 613,3 Па, давлением пара. По этой причине лед, опущенный в такой раствор, будет быстро таять. Лишь при некоторой температуре, лежащей ниже 0°С, давление пара над раствором уменьшится настолько, что станет равным давлению пара льда при той же температуре. Таким образом, раствор будет замерзать при более низкой температуре, чем чистый растворитель. Например, раствор, содержащий 0,1 кг поваренной соли в 1 кг воды, замерзает, как показывает опыт, не при 273,16 К, а при 259,56 К, морская вода — при 270,66 К.
Второй закон Рауля.Процессы замерзания и кипения растворов были детально изучены Раулем (1882), который установил закон, впоследствии названный его именем и характеризуемый уравнением:
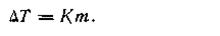
| 4.9 |
Это и есть математическое выражение второго закона Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально его моляльной концентрации.
Коэффициент К в уравнении (4.9) носит название криоскопической постоянной (греч. kryos — холод). Она представляет собой величину, характерную для данного растворителя, и показывает понижение температуры замерзания, вызываемое растворением 1 моль вещества (неэлектролита) в 1 кг этого растворителя.
В самом деле, из уравнения (4.9) следует, что при m= 1 ∆T = К. Криоскопическая постоянная является постоянной величиной, она не зависит от природы растворенного вещества, а только от природы растворителя. Численные значения криоскопических констант (в К) для некоторых растворителей приведены ниже:
Таблица 4.3 Криоскопические постоянные растворителей
| Вода Н2О…………….…1,86 | Уксусная кислота СН3СООН ……………………….3,90 |
| Бензол С6Н6…………….....5,12 | Анилин C6H5NH2 ………………………..5,87 |
| Нафталин С10Н8..………..........6,90 | Фенол С6Н5ОН ………..…………………7,27 |
| Нитробензол C5H5NO2…. ………6,90 |
Аналогична криоскопической постоянной константа кипения, или эбулиоскопическая постоянная (лат. ebulyo — вскипать). Она характерна для данного растворителя и показывает, на сколько градусов повышается температура кипения при растворении 1 моль неэлектролита в 1 кг растворителя. Численные значения эбулиоскопических констант кипения (в К) приведены ниже:
Таблица 4.4 Эбулиоскопические постоянные растворителей
| Вода…………………………… 0,516 | Этиловый спирт………………….1,16 |
| Бензол……………………………2,57 | Уксусная кислота……………………… 3,10 |
| Анилин………………………… 3,69 | Четыреххлористый углерод …………5,00 |
Напомним, что математическое выражение второго закона Рауля в случае изменения температуры кипения растворов будет совершенно аналогично уравнению (4.9), только вместо криоскопической постоянной (К) берут эбулиоскопическую константу (E):
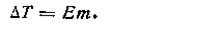
| 4.10 |
Свойство растворов понижать температуру замерзания воды широко используется в практике для приготовления так называемых антифризов, которые представляют собой водные растворы некоторых органических и неорганических веществ. Эти растворы не замерзают при низких температурах и потому широко применяются для охлаждения двигателей автомобилей и тракторов в условиях Крайнего Севера. Например, такой антифриз, как 55%-ный раствор этиленгликоля в воде, не замерзает даже при температуре 233 К.
Понижение температуры замерзания растворов имеет большое значение для живых организмов. Так, сок в их клетках представляет собой в основном раствор органических веществ; его температура замерзания лежит ниже 273 К, поэтому организмы не погибают при пониженных температурах. Характерно отметить, что зимостойкость растений обусловлена концентрацией клеточного сока: чем выше концентрация, тем более низкие температуры может переносить растение. Процесс превращения более высокомолекулярных соединений в соединения с меньшей молекулярной массой при наступлении холодов (например, крахмала в углеводы типа глюкозы), протекающий в клетках растений, также вызван стремлением повысить концентрацию клеточного сока. По этой же причине хорошо сохраняются овощи и фрукты при температуре 272 К.
Методы измерения концентрации клеточного сока по температурам замерзания растворов в настоящее время широко используются в селекционной работе при выведении новых зимостойких сортов различных сельскохозяйственных культур.
Дата добавления: 2016-02-20; просмотров: 3698;
