Понижение давления насыщенного пара растворителя.
Давление насыщенного пара жидкости при данной температуре является постоянной величиной. Так, при 293 К давление насыщенного пара воды равно 2,319 · 103 Па, спирта 5,852 · 103 Па, эфира 5,8928 · 104 Па и т. д. Испарение является эндотермическим процессом, поэтому согласно принципу Ле Шателье повышение температуры сдвигает равновесие в сторону дальнейшего парообразования, т. е. с увеличением температуры давление насыщенного пара также увеличивается.
Опыт показывает, что давление насыщенного пара над жидкостью при постоянной температуре понижается, если в ней растворить некоторое количество другого вещества. Это объясняется действием ван-дер-ваальсовых сил между молекулами растворителя и растворенного вещества. Растворяя небольшое количество какого-либо вещества в растворителе, мы понижаем концентрацию последнего в единице объема и тем самым уменьшаем число молекул растворителя, покидающих поверхность раствора в единицу времени. В результате — давление пара над раствором всегда меньше, чем над чистым растворителем. При этом понижение давления пара тем больше, чем больше концентрация растворенного вещества в растворе.
Первый закон Рауля.Обобщая результаты экспериментальных наблюдений, французский физик Рауль (1887) установил, что давление насыщенного пара растворителя над раствором равно его давлению над чистым растворителем, умноженному на молярную долю растворителя в растворе, т. е.
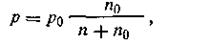
| 4.5 |
где ро — давление насыщенного пара над чистым растворителем; р — давление насыщенного пара над раствором; п0 — число молей растворителя; п — число молей растворенного вещества. Уравнение (4.5) получило название первого закона Рауля. На практике чаще всего применяют другую, более удобную форму этого закона. Так, если обе части уравнения (4.5) разделить на р0, а затем молярную долю растворителя заменить молярной долей растворенного вещества, то (зная, что 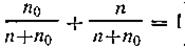 ) получим
) получим
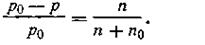
| 4.6 |
Это уравнение тождественно уравнению (4.5) и читается так: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе. Это и есть формулировка первого закона Рауля.
Так как для сильно разбавленных растворов п по сравнению с n0 очень мало, им можно пренебречь, и формула (4.6) примет вид
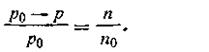
| 4.7 |
Относительное понижение давления пара для данного раствора не зависит от природы растворенного вещества и растворителя, а также от температуры. Оно зависит лишь от концентрации раствора.
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Закон Рауля соблюдается тем точнее, чем более разбавлен раствор. По мере повышения концентрации в большинстве растворов возникает отклонение от идеального состояния, особенно в растворах солей, кислот и оснований. Объяснение этому явлению будет дано несколько позднее.
На основании первого закона Рауля можно вычислить молекулярные массы растворенных веществ. Если р0 — упругость пара чистого растворителя, р — раствора, содержащего ω граммов растворенного вещества, т — молекулярная масса растворенного вещества, М — молекулярная масса растворителя, W — масса растворителя (в г), то из уравнения (4.7) получим
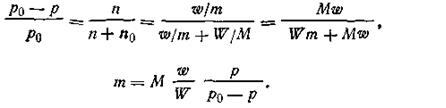
| 4.8 |
Дата добавления: 2016-02-20; просмотров: 1406;
