Растворы — физико-химические системы. Концентрация растворов. Сущность процесса растворения.
Растворами называют состоящие из двух или нескольких веществ гомогенные системы, состав которых может изменяться в довольно широких пределах. Свойства растворов (плотность, температура кипения, температура замерзания, вязкость и др.), как правило, изменяются постоянно, плавно.
Растворы сходны как с механическими смесями частиц, так и с индивидуальными химическими соединениями. От первых они отличаются тем, что любой макроскопический объем раствора обладает таким же химическим составом и физическими свойствами, как и вся его масса. От химических соединений растворы отличаются тем, что их состав может изменяться в зависимости от количеств взятых компонентов и они не подчиняются закону кратных отношений. Так, состав водного раствора хлорида натрия может произвольно меняться в пределах, допустимых его растворимостью. В 100 г воды при 293 К можно растворить любое количество NaCl в пределах от 0 до 36,8 г, что соответствует предельной растворимости соли при данной температуре. Растворы отличаются от химических соединений также и природой связи. Если для химических соединений характерны в основном ионная и ковалентная связи, то для растворов характерны более слабые ван-дер-ваальсовы, а в некоторых случаях и водородные связи.
В отличие от простого смешивания при растворении веществ происходит определенное взаимодействие между частицами, образующими раствор. Вещество, которое при растворении не меняет своего агрегатного состояния или же входит в состав раствора в преобладающем количестве, обычно называют растворителем. Необходимо отметить, что понятия «растворитель» и «растворенное вещество» имеют смысл лишь в том случае, когда концентрация растворенного вещества в растворителе невелика. Если взять раствор, содержащий 50% спирта и 50% воды, то его в одинаковой мере можно рассматривать как раствор спирта в воде и воды в спирте. В подобных случаях удобнее говорить о компонентах раствора.
По агрегатному состоянию растворы делят на три группы: 1) растворы газов в газах (газовые смеси); 2) жидкие растворы; 3) твердые растворы (изучаются с фазовыми равновесиями).
Пример твердых растворов — сплавы различных металлов, пример газообразных — воздух.
Жидкие растворы в свою очередь подразделяются на растворы газов в жидкостях, растворы жидкостей в жидкостях, растворы твердых тел в жидкостях.
Особое значение имеют водные растворы, так как подавляющее большинство процессов в природе совершается в водной среде. Водные растворы играют исключительно важную роль во всех процессах, протекающих в почвах, а также в животных и растительных организмах. Все природные воды (морская, речная, воды минеральных источников и т. п.) представляют собой не что иное, как растворы различных солей. Различные биологические жидкости: плазма крови, лимфа, соки растительных организмов и другие — также содержат в растворенном состоянии органические и неорганические вещества. Иными словами, растворы — наиболее распространенные системы в природе, и потому учение о растворах является важным разделом физической химии.
Процесс растворения нельзя рассматривать как простое механическое распределение одного вещества в другом. При растворении имеет место физико-химическое взаимодействие растворяемого вещества с молекулами растворителя. Процесс растворения часто сопровождается выделением или поглощением теплоты (теплота растворения), а также уменьшением или увеличением объема раствора. Так, растворение серной кислоты или гидроксида натрия в воде сопровождается таким же тепловым эффектом, как и обычные химические реакции. Это свидетельствует о том, что молекулы (или ионы) растворенного вещества образуют с молекулами растворителя химические соединения. Эти соединения называют сольватами, а процесс их образования — сольватацией; в случае, когда растворителем является вода, их называют гидратами, а процесс их образования — гидратацией.
Когда учение о растворах выделилось в самостоятельный раздел химии, определились две точки зрения на природу растворов, две теории растворов — физическая и химическая.
Основы физической теории растворов были заложены уже во второй половине XIX в. Сванте Аррениусом и Вант-Гоффом. Согласно этой теории процесс растворения рассматривается как чисто физический процесс равномерного распределения частиц растворяемого вещества по всему объему растворителя, который представляет собой некую индифферентную среду. При этом допускают, что никакого взаимодействия между молекулами растворителя и частицам растворенного вещества не существует. Физическая теория растворов подкреплялась тем, что целый ряд свойств растворов — повышение температуры кипения, понижение температуры замерзания, давление пара, осмотическое давление — действительно зависит только от концентрации растворенного вещества, но не зависит от его природы. Таким образом, растворы, согласно этой теории, представляются как однородные смеси молекул, в которых состояние растворенного вещества подобно состоянию газа.
Однако по мере накопления фактического материала постепенно физическая теория растворов уступила место так называемой гидратной теории, основоположником которой был Д. И. Менделеев Значительный вклад в эту теорию позднее внесли И. А. Каблуков, Н. С. Курнаков и другие советские ученые.
Д. И. Менделеев на основании исследований свойств водных растворов серной кислоты, этилового спирта и других веществ пришел к выводу, что между молекулами компонентов раствора существует взаимодействие, приводящее к образованию нестойких соединений частиц растворенного вещества с молекулами растворителя. Так, в растворах серной кислоты Менделеев установил наличие гидратов следующего состава: H2SO4·H2O, Н2SО4·2Н2О, H2SO4·4H2O и др. Он установил также, что соединение молекул или ионов растворяемого вещества с молекулами растворителя осуществляется главным образом за счет водородной связи или же вследствие электростатического взаимодействия полярных молекул веществ.
Наиболее изучены разбавленные растворы. В них частицы растворенного вещества настолько отделены друг от друга молекулами растворителя, что взаимодействие между ними выражено очень слабо и природа растворенного вещества практически не оказывает влияния на свойства разбавленного раствора. Аналогично свойствам газа свойства разбавленных растворов не зависят от состава частиц растворенного вещества и их размеров, а только от числа частиц в единице объема, т. е. от концентрации. Процесс растворения является сложным физико-химическим процессом, в котором наиболее ярко проявляется взаимодействие между частицами (молекулами или ионами) различной химической природы.
На процессы растворения многих веществ, находящихся в различных агрегатных состояниях, большое влияние оказывает полярность молекул растворителя и растворенного вещества. Она выражается в том, что в силу неравномерного распределения электрических зарядов в одной части молекулы могут преобладать положительные заряды, а в другой отрицательные. Полярность отражается на многих свойствах молекул.
В жидкостях полярные молекулы взаимно ориентируются, образуя ассоциаты различной величины и прочности. Это явление имеет место при растворении веществ, состоящих из полярных молекул, в неполярных растворителях. В качестве примера можно указать такие вещества, как бензойная кислота С6Н5СООН, этиловый спирт С2Н5ОН и др., молекулы которых, находясь в растворенном состоянии в бензоле (неполярная жидкость), в большей или меньшей степени ассоциированы по две и более в одну частицу.
В растворе всякая заряженная частица, будь то ион или полярная молекула, окружается сольватной оболочкой, которая состоит из ориентированных соответствующим образом молекул растворителя. Если растворителем является вода, то употребляют термин гидратная оболочка, а само явление носит название гидратации.
Степень гидратации различных ионов и молекул неодинакова и зависит как от величины зарядов этих частиц, так и от их размеров. Чем больше заряд и меньше размеры, т. е. чем выше удельная плотность заряда, тем сильнее выражена гидратация. Таким образом, гидратные оболочки удерживаются электростатическими силами притяжения.
Полярные группы молекул растворенного вещества могут образовать также водородные связи с молекулами воды.
Способностью гидратироваться при растворении обладают не только кристаллические, но также газообразные и жидкие вещества. Гидраты (сольваты) являются соединениями все же менее прочными, чем обычные химические соединения. Они легко могут разрушаться даже при незначительном повышении температуры.
Процесс растворения веществ обусловлен взаимодействием частиц растворенного вещества с молекулами растворителя. Механизм растворения твердых тел в жидкости состоит в основном из трех стадий. В качестве примера рассмотрим растворение кристалла хлорида натрия, который состоит из электростатически связанных ионов натрия и хлора. Как известно, между ионами Na+ и Сl- имеет место ионная связь, между молекулами воды действуют силы Ван-дер-Ваальса и водородная связь, а между ионами натрия и хлора, с одной стороны, и полярными молекулами воды — с другой стороны, возникает ионно-дипольная связь. Все эти виды связи как бы конкурируют между собой. При погружении кристалла в воду полярные молекулы Н2О ориентируются таким образом, что к иону Na+ они обращены своими отрицательными полюсами, а к иону Сl- — положительными (рис. 4.1), т. е. происходит явление гидратации этих ионов.
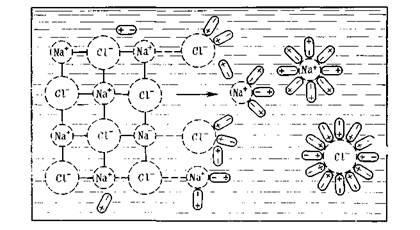
Рис. 4.1. Схема растворения кристалла поваренной соли в воде
Образованная в результате гидратации ионно-дипольная связь оказывается прочнее, чем межионная связь Na+ — Сl-. В результате теплового движения происходит полный разрыв этой связи у ионов, расположенных у поверхности кристалла.
На второй стадии растворения происходит гидратация тех ионов, которые полностью перешли в раствор. Третья стадия растворения— это самопроизвольный процесс диффузии гидратированных ионов по всему объему растворителя.
Многие кристаллические вещества, относящиеся к неэлектролитам, также обладают высокой растворимостью в воде, что объясняется присутствием в их молекулах полярных групп, способных гидратироваться.
Из рассмотренного выше механизма растворения видно, что на разрушение кристаллической решетки необходимо затратить какое-то количество энергии. С другой стороны, гидратация ионов (или полярных молекул) растворяемого вещества сопровождается выделением энергии в виде теплоты. Таким образом, тепловой эффект растворения является суммой двух слагаемых: а) энергии гидратации (в общем случае — сольватации) и б) энергии кристаллической решетки.
Процесс гидратации всегда сопровождается выделением теплоты. Подсчитано, что энергия гидратации составляет примерно 142 кДж/моль в том случае, если к каждому иону присоединяется по одной молекуле воды. Процесс разрушения кристаллической решетки, наоборот, является эндотермическим, т.е. он протекает с поглощением теплоты. Суммарный тепловой эффект растворения складывается из алгебраических величии энергии разрушения кристаллической решетки твердого вещества и перевода его в жидкое состояние и энергии гидратации. Если затраты энергии на растворение какого-либо вещества больше выделяющейся энергии гидратации, то процесс растворения будет эндотермичным. Если же теплота гидратации больше теплоты, необходимой для разрушения кристаллической решетки, то процесс растворения будет экзотермичным. Так, при растворении гидроксида натрия NaOH температура раствора повышается почти до 373 К, а при растворении роданида аммония NH4SCN понижается до 253 К.
Дата добавления: 2016-02-20; просмотров: 6908;
