Роль атомного строения металлов
Среди многих показателей, связанных с особенностями атомного строения металлов, для сварки наибольшее значение имеют следующие:
- прочность связи наиболее легко отделяемых электронов внешней оболочки с ядром или ионом;
- тип и прочность связи между атомами;
- показатель свободной энергии поверхности.
В атоме электроны внешней оболочки наименее прочно связаны с ядром, что обусловлено наибольшим удалением этих электронов от ядра и экранирующим влиянием силовых полей электронов промежуточных оболочек. Известно также, что прочность связи электронов внешней оболочки с ядром тем больше, чем выше степень заполнения внешнего электронного уровня электронами.
Для образования сварного соединения при сварке давлением необходимо, чтобы между атомами свариваемых поверхностей, сближенных на определенное расстояние, установился электронный обмен. Только в этом случае может образоваться надежное неразъемное соединение.
Для установления между свариваемыми поверхностями электронного обмена необходимо, чтобы наименее прочно связанные с ядром электроны внешних электронных оболочек были способны отделиться от своего атома и перейти на внешнюю электронную оболочку атома другой свариваемой поверхности или же атомы обеих свариваемых поверхностей были способны «владеть» одновременно какими-то электронами внешних оболочек обоих атомов. Таким образом произойдет объединение атомов свариваемых поверхностей, и образуется прочная связь.
О способности металлов образовывать неразъемное сварное соединение в результате объединения атомов сближаемых поверхностей можно, в определенной мере, судить по закреплению электрона на внешнем электронном уровне атома. Чем прочнее это закрепление и больше энергия связи, тем труднее электрону оторваться от своего атома и принять участие в электронном обмене с атомами другой свариваемой поверхности.
Оценить свариваемость металлов сваркой давлением можно по особенностям строения атома и величине энергии (работы), которую надо затратить на отрыв электрона от атома.
К особенностям строения атома можно отнести атомный радиус – расстояние от центра ядра до внешней электронной оболочки. Чем больше это расстояние, тем меньше энергия связи внешнего электрона с ядром, и соответственно тем выше способность электрона к отрыву от атома и к сварке давлением. Ниже приведены атомные радиусы некоторых элементов (табл. 1).
Таблица 1 – Атомные радиусы элементов
| Элемент | Mg | Al | Ti | V | Cr | Mn | Fe | Co |
| Атомный радиус, нм | 1,60 | 1,43 | 1,47 | 1,36 | 1,30 | 1,27 | 1,26 | 1,25 |
Продолжение таблицы 1
| Элемент | Ni | Cu | Zn | Zr | Nb | Mo | Ag | Pt | Au |
| Атомный радиус, нм | 1,25 | 1,28 | 1,37 | 1,60 | 1,47 | 1,39 | 1,44 | 1,39 | 1,46 |
Данные элементы можно объединить в 13 групп. Свариваемость, определяемая только расстоянием от электрона до центра ядра, должна убывать от 1-й до 13-й группы (табл. 2).
Таблица 2 – Группы свариваемости
| Группа | |||||||
| Элементы | Mg, Zr | Ti, Nb | Au | Ag | Al | Мо, Pt | Zn |
Продолжение таблицы 2
| Группа | ||||||
| Элементы | V | Cr | Cu | Mn | Fe | Со, Ni |
Об экранирующем влиянии силовых полей промежуточных оболочек химических элементов можно судить по их электронному строению, определяемому энергетическим состоянием атомов промежуточных электронных уровней. Общее число электронов (порядковый номер элемента в периодической системе) равно положительному заряду ядра. При мало отличающихся радиусах заполнение объема атома оболочками и электронами возрастает с увеличением атомной массы элемента. Поэтому ориентировочно атомную массу элемента можно считать показателем плотности экранирующего поля внутренних оболочек атома.
Чтобы учесть влияние плотности экранирующего поля, можно ввести условный показатель – общий удельный заряд а1, равный частному от деления общего заряда на атомную массу общего числа электронов, и экранирующий удельный заряд а2, равный частному от деления заряда экранирующих электронов на атомную массу. Если значение а1 – а2 близко к нулю, то электроны внешнего уровня прочно связаны с атомом. Чем больше эта разность и чем слабее связь внешних электронов с атомом, тем легче они отделяются и, следовательно, лучше свариваются элементы.
Второй показатель, от которого зависит свариваемость при сварке давлением, – величина энергии, которую надо затратить на отрыв электрона от атома. Для разных металлов способность к электронному обмену различна, она зависит от энергии связи внешних электронов с атомами. Физическими показателями энергии связи могут служить потенциал ионизации и энергия выхода электронов при образовании двойного электрического слоя. Чем ниже ионизационный потенциал, тем легче устанавливается электронный обмен и тем лучше свариваются металлы. Другим физическим показателем связи электрона с атомом является энергия выхода электрона, равная разности энергии внутреннего и внешнего электронов. Значения первых потенциалов ионизации (для отрыва первого электрона, что достаточно для начала электронного обмена между свариваемыми поверхностями) и энергии выхода для электронов некоторых элементов приведены в табл. 3.
Таблица 3 – Физические показатели связи электронов с атомами
| Элемент | Mg | Al | Ti | Fe | Ti | Cu | Ag |
| Потенциал ионизации, эВ | 7,64 | 5,98 | 6,82 | 7,87 | 7,86 | 7,72 | 7,57 |
| Энергия выхода электрона, эВ | 3,60 | 4,20 | 4,10 | 4,70 | 4,40 | 4,50 | 4,30 |
Используя данные об атомном радиусе, энергии связи электронов с ядром, можно судить о способности металлов к образованию сварного соединения при надлежащем контакте в результате установления электронного обмена и создания металлической связи.
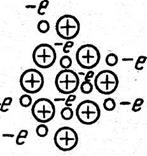
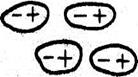
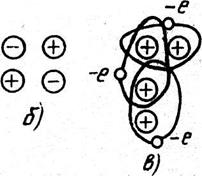
Тип и прочность связи между атомами. Между атомами может быть четыре типа связей (рис. 5): полярная (молекулярная Ван-дер-Ваальса), ионная (гетерополярная), ковалентная (гомеополярная) и металлическая.
 |

 |

 а б в г
а б в г
а – полярная; б – ионная; в – ковалентная; г – металлическая
Рисунок 5 – Типы связей между атомами
При полярной связи не происходит электронного обмена между атомами, а только смещение электронов в одном направлении, что создает предпосылки для электромагнитного взаимодействия между двумя поляризованными атомами.
При ионной связи происходит электронный обмен – электрон переходит с одного атома на другой, при этом первый становится электроположительным, а второй – электроотрицательным. Взаимодействие различно заряженных ионов определяет связь в кристаллах.
При ковалентной связи также имеет место переход электронов с внешних оболочек атомов и объединение их попарно в цепочки связи. При установлении металлической связи происходит переход электронов с внешних оболочек. Оторвавшиеся электроны принадлежат не двум соседним атомам, а всем атомам кристалла (металла).
Металлический тип связи характерен для соединений большей части металлов, ковалентная связь – для соединений Cu, Ag, Аu, Zn, Cd, Al c Li, Cr, Mg, Sr.
Ионная связь имеет место в соединениях Si, Sn, Рb, Ge c Se, Te, O, S, H, Cl.
Состояние атомов, находящихся на поверхности металла, существенно отличается от состояния атомов, расположенных внутри кристаллов. Связи поверхностных атомов неуравновешенны, что приводит к образованию поверхностного слоя атомов с усиленными связями в плоскости поверхности, т.е. к поверхностному натяжению. Поверхностное натяжение (поверхностная энергия) является фактором, обусловливающим противодействие активации поверхности, например выходу на поверхность дислокаций. Оно же затрудняет отрыв электронов внешней оболочки и установление электронного обмена, необходимого при сварке давлением, поэтому значение поверхностной энергии металлов может служить фактором, характеризующим противодействие образованию сварного соединения при сварке давлением.
Дата добавления: 2016-01-09; просмотров: 1500;
