Показатели качества воды прудовых хозяйств
| Показатель | Вид прудов | Технологическая норма | Допустимые значения, до |
| Кислород, Г/М3 | Карповые в поликультуре | 6-8 | 4, понижение к |
| утру не менее 2 | |||
| Форелевые | 9-11 | — | |
| Диоксид углерода, г/м3 | Для всех прудов | ||
| Сероводород, г/м3 | Тоже | Нет | Нет |
| БПК5, г О2/м3 | Карповые | 4-9 | |
| Карповые в поликультуре | 4-15 | ||
| Форелевые | 2,5-5,0 | 8,0 | |
| Окисляемость: | |||
| перманганатная, | Карповые в поликультуре | 10-15 | |
| гО/м3 | Форелевые | 6-10 | |
| бихроматная, г О/м3 | Карповые в поликультуре | 35-70 | |
| Форелевые | 25-45 | ||
| Аммиак свободный N, | Для всех прудов | 0,01-0,05 | 0,5 |
| г/м3 | |||
| Аммоний-ион, г N/м3 | Карповые в поликультуре | 0,5 | 1,0 |
| Форелевые | 0,2 | 0,5 | |
| Нитрит-ион, г N/м3 | Карповые в поликультуре | 0,08 | 0,2 |
| Форелевые | 0,05 | 0,1 | |
| Нитрат-ион, г N/м3 | Карповые в поликультуре | 0,2-1,0 | 3,0 |
| Форелевые | 0,5 | 1,0 | |
| Фосфат-ион, г Р/м3 | Карповые в поликультуре | 0,1 | 0,5 |
| Форелевые | 0,05 | 0,3 |
тоже свидетельствует о повышенном загрязнении водоема клетчаткой и проявляется при ее гниении.
В водоемах, где образуются сероводород и метан, часто наблюдаются летние и особенно зимние заморы рыб. Наличие даже следов сероводорода свидетельствует об антисанитарном состоянии рыбоводных прудов и других емкостей. Поэтому в рыбохозяйственных водоемах сероводород должен отсутствовать. Для частичного удаления сероводорода и метана эффективна аэрация воды, а для предотвращения их появления необходима очистка водоемов от загрязнений (иловых отложений, органических веществ и т. д.).
Солевой состав воды.Под солевым составом воды понимают совокупность растворенных в ней минеральных и органических соединений. В зависимости от количества растворенных солей различают воду пресную (до 0,5 %о) (%о — промилле — содержание солей в г/л воды), солоноватую (0,5—16,0 %о), морскую (16—47 %о) и пересоленную (более 47 %о). Морская вода содержит в основном хлориды, а пресная — карбонаты и сульфаты. Поэтому пресная вода бывает жесткой и мягкой. Слишком опресненные, так же как и пересоленные, водоемы малопродуктивны. Соленость воды — один из основных факторов, обусловливающих обитание рыб. Одни рыбы живут только в пресной воде (пресноводные), другие — в морской (морские). Проходные рыбы сменяют морскую воду на пресную и наоборот. Осолонение или опреснение вод обычно сопровождается изменением состава ихтиофауны, кормовой базы, а нередко приводит к изменению всего биоценоза водоема.
В воде водоемов содержатся практически все химические элементы, но только немногие из них, так называемые биогенные, присутствуют в больших количествах. Остальные являются микроэлементами. Определенные концентрации и правильное соотношение этих элементов играют важную положительную роль в жизни водоемов. Биогенные элементы (азот, фосфор, калий, кальций, магний, кремний, железо) напрямую способствуют развитию фитопланктона, а косвенно — животных (планктонных и бентосных), служащих пищей для рыб. Фосфор, кальций, натрий, калий, хлор, железо и другие элементы, проникая через жабры, кожу и слизистые оболочки в организм рыб, включаются в обмен вещест п и тем самым улучшают их рост и развитие.
Однако слишком большое поступление в водоем биогенных элементов и других минеральных солей может принести большом вред, вплоть до отравления рыб, и поэтому рассматривается как загрязнение водоемов. Для оценки качества воды по ее химическому составу применяют как общие (жесткость, рН, окисляемость), так и специфические гидрохимические показатели: азот аммонийный, нит-ритный, нитратный, хлориды, сульфаты и др. (см. табл. 1).
Жесткость воды. Под жесткостью воды понимают общее содержание растворенных солей кальция, магния и других щелочноземельных металлов. В воде рыбохозяйственных водоемов содержатся в основном бикарбонат-карбонатные соли кальция и магния и в
меньшем количестве их сульфаты и хлориды. В водоемы они поступают в результате вымывания из почвы и образования в процессе биохимического разложения органических веществ.
Различают жесткость общую, устранимую (или карбонатную) и постоянную. Общая жесткость — это общее содержание в воде всех солей щелочноземельных металлов. Устранимая жесткость обусловлена наличием бикарбонатов кальция и магния, которые при кипячении воды выпадают в осадок. Постоянная жесткость — это жесткость, сохраняющаяся после кипячения воды и зависящая от содержания в воде сульфатов, хлоридов, фосфатов и других солей кальция и магния.
Жесткость воды чаще выражают в миллиграмм-эквивалентах кальция и магния в литре воды или в немецких градусах. Один миллиграмм-эквивалент жесткости равен содержанию 20,04 мг/л кальция или 12,15 мг/л магния, а один немецкий градус соответствует' 10 мг СаО/л воды. Для пересчета 1 мг • экв. в немецкие градусы полученный результат умножают на коэффициент 2,8.
По жесткости различают следующие типы воды: мягкая — 4 мг • экв/л, среднежесткая — 4—8 мг • экв/л, жесткая — 8— 12 мг • экв/л. Для пресноводных рыб благоприятна мягкая и средне-жесткая вода.
Санитарно-зоогигиеническое значение жесткости заключается в том, что она отражает степень минерализации воды, характеризует течение биохимического разложения органических веществ и ее буферные свойства. Мягкая вода обычно более кислая, а жесткая — щелочная. Повышение жесткости часто связано с обогащением воды диоксидом углерода, который образуется в результате минерализации органических веществ, загрязняющих водоем. Соли кальция и магния регулируют буферные свойства воды, связывают многие токсические вещества (соли тяжелых металлов и др.), переводят их в нерастворимые осадки, а также положительно влияют на резистентность организма рыб к некоторым болезням и токсикозам. Слишком мягкая вода нежелательна для рыбоводных целей потому, что из-за недостатка в ней солей кальция, магния и других рыбы недополучают эти биогенные элементы через воду и их необходимо компенсировать добавлением извести в корма. Особенно важно соблюдать нормативы жесткости для лососевых рыб и в хозяйствах, где используют искусственные корма. Кроме того, слишком мягкая, малозабуференная вода имеет неустойчивую реакцию среды (рН), а попадающие в нее минеральные стоки более токсичны, чем в жесткой.
Активная реакция воды (рН). Показатель концентрации водородных ионов (рН) отражает буферное состояние воды, ее кислотность или щелочность и является одним из важнейших абиотических факторов внешней среды.
В воде рН регулируется соотношением водородных и гидро-ксильных ионов, а также буферной бикарбонат-карбонатной системой. При повышенном содержании в воде водородных ионов и
свободного диоксида углерода происходит закисление воды, а при накоплении гидроксильных ионов и гидрокарбонат-ионов — ее за-щелачивание.
На буферную емкость воды влияют также растворимые бораты, силикаты, фосфаты и в меньшей степени органические амины, аммиак и др. Пресные воды в отличие от морских, где рН относительно стабилен (7,5—8,5), характеризуются неустойчивой реакцией среды, и, следовательно, пресноводные рыбы более приспособлены к колебаниям рН, чем морские. Это связано с разнообразными факторами: характером почв ложа и водосборной площади, фотосинтезом водных растений, содержанием органических веществ, а также поступлением в водоемы различных загрязнений.
Природными источниками закисления воды могут быть избыточное накопление диоксида углерода при активном разложении органических веществ, поступление стоков болотных вод, содержащих много органических кислот, а также разложение железистых вод. рН болотных и железистых вод менее 4,0. Низкие значения рН наблюдаются весной в период таяния снега. Резкие суточные колебания рН отмечаются летом во время «цветения» воды. В последние 15—20 лет отмечаются изменения рН воды открытых водоемов в результате антропогенного загрязнения их сточными водами различных предприятий, а также выпадания с атмосферными осадками дымовых выбросов (кислотные дожди), содержащих нитраты, хлориды и др.
Такие нарушения рН оказывают отрицательное воздействие не только на физиологическое состояние гидробионтов и, в частности, рыб, но и на их паразитов — возбудителей заразных болезней, кормовые организмы и др. Как в кислой, так и в щелочной среде у рыб нарушаются дыхание и газообмен. Поэтому оптимальными условиями существования гидробионтов являются нейтральная, слабокислая или слабощелочная среда.
Для пресноводных рыб в качестве безопасного принят рН 6—9, а для максимальной продуктивности водоемов требуется рН 6,5—8,5.
Эти общие закономерности распространяются и на возбудителей заразных болезней рыб на тех фазах их развития, когда они находятся непосредственно в воде (яйца, свободноживущие личинки, грибы, бактерии, вирусы и т. д.) или паразитируют на поверхности тела и в жаберной полости рыб, постоянно омываемой водой.
В литературе есть указания на то, что при определенных значениях рН создаются благоприятные условия для возникновения ряда заразных болезней. Так, кислая среда (рН 6,4) нередко способствует заболеванию карпа хилодонеллезом и гиродактилезом, а также сохранению неблагополучного состояния прудов по оспе карпов. В то же время увеличение рН до 8,5—9,0 вызывает замедление развития и гибель некоторых бактерий и грибов. Поэтому повышение рН воды используют в целях профилактики болезней. Активную реакцию воды (рН) определяют потенциометрически или экспресс-методом с универсальным индикатором.
Окисляемость воды. Интегральный показатель окисляемости воды отражает уровень загрязнения водоема органическими и некоторыми другими веществами. Он выражается количеством атомов кислорода (г О/м3 воды), необходимого для окисления органических веществ. Общее количество органического вещества определяют по бихроматной, а легкоокисляемые вещества — по перманга-натной окисляемости. Кроме того, в качестве дополнительного используют показатель биохимического потребления кислорода (ВПК), т. е. количество кислорода (г О2/м3), пошедшее на дыхание микроорганизмов и простейших, а также на окисление легкоокисляющихся веществ до начала нитрификации. С увеличением количества органических веществ в воде повышается количество микроорганизмов, и преимущественно за счет этого увеличивается ВПК. Расход кислорода за определенный промежуток времени (1; 5; 20 сут) в исследуемой пробе определяют по разности между содержанием его до и после инкубации воды в стандартных условиях (постоянная температура 20 °С). Все эти определения позволяют получать полную информацию о наличии легкоокисляемого химически и биологически органического вещества.
Содержащиеся в воде органические вещества, если их количество не слишком велико, благоприятствуют поддержанию жизни в воде, так как являются пищей для огромного количества мелких гидробионтов. При этом окисляемость воды не превышает 8— 10 г О/м3 и в воде устанавливается равновесие в расходовании кислорода: его хватает на окисление органических веществ и на дыхание водных животных.
При сильном загрязнении водоемов органическими веществами в результате их накопления, поступления сточных вод (коммунально-бытовых, животноводческих и др.) или неконтролируемого применения интенсификационных мероприятий в рыбоводстве (внесение органических удобрений, кормление рыбы и т. д.) окисляемость воды резко возрастает. В результате снижается концентрация кислорода в воде и создаются благоприятные условия для возникновения заразных болезней (аэромонозов и псевдомонозов, бранхиомикоза и др.). Поэтому для профилактики болезней необходимо поддерживать окисляемость воды в пределах рыбоводных нормативов (см. табл. 1).
Соединения азота (аммиак, нитриты и нитраты). В воде рыбохо-зяйственных водоемов азот находится в нескольких формах: растворенного молекулярного азота и в виде различных органических и минеральных соединений — азота альбуминоидного, аммиачного и аммонийного, нитритов, нитратов и др. Поскольку азот является одним из основных биогенных элементов, входящих в состав растительных и животных организмов, все эти формы присутствуют в водоемах и проходят определенный цикл превращений (круговорот). Он начинается с образования аммиака или его ионизированной формы — аммонийного азота, которые поступают в воду как конечные продукты жизнедеятельности водных животных, при
разложении отмирающих водных организмов, а также при экзогенном загрязнении водоемов органическими сточными водами, удобрениями и др. Разложение органических веществ в водоеме происходит с участием нескольких групп бактерий и включает в себя ряд стадий. Первыми начинают процесс минерализации сапрофитные бактерии, разлагающие азотсодержащие органические вещества до альбуминоидного и затем аммонийного азота. Далее он проходит две фазы нитрификации. В I фазу с участием нитрозобактерий аммонийный азот окисляется до нитритов; во II фазу под воздействием нитробактерий нитриты окисляются до нитратов, которые усваиваются растениями.
Оптимальным для рыбоводных прудов считается содержание в воде общего минерального азота до 2 мг/л. Повышение содержания общего азота или отдельных его соединений, а также нарушение соотношений этих форм являются важными показателями зоогигие-нического состояния рыбохозяйственных водоемов.
Аммиак присутствует в воде в двух формах: неионизированной — свободный аммиак (NH3) и ионизированной — аммонийные ионы (NH+). Соотношение свободного аммиака и аммонийных ионов сильно зависит от рН и температуры воды: при повышении температуры и сдвиге рН в щелочную сторону доля свободного аммиака резко возрастает. Например, при температуре 20 °С содержание свободного аммиака в воде с рН 7,0 составляет 0,4 %, с рН 8,0 — 3,82, с рН 9,0 — 28,6 и с рН 10 — 79,7 %. Изменение температуры воды на 10 °С приводит соответственно к изменению его доли примерно в 2 раза, за исключением рН 10, где эта разница менее выражена. Учитывая, что в рыбоводной практике обычно определяют суммарное содержание этих форм, количество свободного аммиака устанавливают расчетным путем, вычитая из общего показателя процентное содержание свободного аммиака при данных рН и температуре воды.
Для гидробионтов, в том числе и для рыб, наиболее опасен неионизированный аммиак, так как он намного токсичнее, чем ионы аммония. Поэтому для оценки качества воды для рыбоводных прудов учитывают обе формы аммиачного азота, допустимые концентрации которых сильно различаются (см. табл. 1). Причем обязательно сопоставляют их уровни с рН и температурой воды, содержанием нитритов и нитратов, а также другими гидрохимическими показателями. Например, присутствие в воде аммиака в сочетании с повышенным уровнем нитритов и нитратов, а также высокой окисляемостью воды свидетельствует о загрязнении водоема органическими веществами, а также указывает на поступление бытовых сельскохозяйственных или промышленных сточных вод. Аммонийный азот в воде определяют колориметрическим методом с реактивом Несслера.
Нитриты (соли азотистой кислоты) — промежуточный продукт биохимического окисления аммиака или восстановления нитратов. В незагрязненной воде они присутствуют в небольших количе-
ствах —от сотых до десятых долей грамма в 1 мэ(см.табл. 1). Более высокое и стабильное повышение их содержания свидетельствует об органическом загрязнении водоемов, так как процесс их образования опережает окисление в нитраты. Параллельно с этим обычно им сопутствуют повышенные концентрации аммиака, хлоридов, сульфатов, высокая окисляемость воды. В повышенных концентрациях нитриты снижают резистентность организма рыб, а иногда даже вызывают отравление. Нитриты определяют в воде методом Грисса с применением сульфаниловой кислоты и а-на-фтил амина.
Нитраты (соли азотной кислоты) встречаются практически во всех водоемах. Но их уровни различаются в зависимости от характера водоисточника, интенсивности рыбоводных процессов, загрязнения прудов органическими веществами и других факторов. Сзоогигиенической точки зрения важно не только учитывать концентрацию нитратов, но и различать, какого они происхождения (органического, минерального, экзогенного загрязнения и др.). При органическом загрязнении водоема повышенное содержание нитратов сочетается с высокими уровнями нитритов и аммонийного азота. Повышенные концентрации только нитратов свидетельствуют о полной минерализации органических веществ, загрязнявших водоем в прошлом, или могут указывать на поступление их со сточными водами и удобрениями. Для нормальной жизнедеятельности рыб содержание нитратов не должно превышать 0,5— 1,0г/м3(см. табл. 1).
Хлориды. Содержание солей хлористоводородной (соляной) кислоты в пресных водоемах редко превышает 40 г С1/м3. Но иногда из засоленных почв они вымываются в больших количествах. Чаще увеличение количества хлоридов в прудах указывает на загрязнение их бытовыми и промышленными водами. При загрязнении органическими веществами увеличение количества хлоридов сочетается с изменениями окисляемости, рН, содержания аммония, нитритов и др. Учитывая, что хлориды нарушают гидрохимический режим и могут снижать резистентность организма рыб, их содержание в прудах не должно превышать 200—300 г С1/м3.
Сульфаты. Происхождение сульфатов в воде может быть минеральным и органическим. Минеральные сернокислые оксиды вымываются из почвы, горных пород, поступают с грунтовыми водами.
Для оценки качества воды большее значение имеют сульфаты органического происхождения, образующиеся в процессе разложения серосодержащих органических веществ через последовательное выделение сероводорода, сульфидов и окисление их до сульфатов. Об органическом источнике появления сульфатов свидетельствуют резкие колебания их концентрации в сочетании с нарушением других гидрохимических показателей. Учитывая эти особенности и слабую токсичность сульфатов для рыб, допустимые их нормативы могут сильно колебаться в зависимости от водоисточника (см. табл. 1).
Фосфаты. В природных водах фосфор находится в растворенном состоянии в виде минеральных солей фосфорной кислоты и органических соединений. Между разными формами фосфора существует подвижное равновесие, которое постоянно изменяется в результате жизнедеятельности организмов. Он является важнейшим биогенным элементом, но при высоких концентрациях вреден для рыб. Если количество общего фосфора повышается до 5— 10 г РО4/м3, это указывает на органическое загрязнение водоемов. При недостатке фосфора в пруды вносят фосфорные удобрения.
В гидрохимической практике чаще определяют растворенный неорганический фосфор (фосфаты). Оптимальное содержание фосфатов должно составлять 0,1 г Р/м3. Не допускается содержание фосфора более 0,5 г Р/м3.
Железо. Это один из важных биогенных элементов, необходимых для жизнедеятельности животных и растений, особенно водорослей. Однако его эффективность зависит от химической формы и доступности для гидробионтов.
Железо поступает в водоемы за счет вымывания из почв, а также спуска в них промышленных стоков. В воде оно присутствует в за-кисной (Fe") и окисной (Fe'") формах. Закисное железо неустойчивое, переходящее в окисное и поглощающее из воды кислород. Оно более токсично для рыб, чем окисное.
Соединения трехвалентного железа и особенно его гидроксид выпадают в виде бурого осадка на дно водоема и растения, оседают на оболочке икры, засоряют жабры гидробионтов, приводя к нарушению дыхания, нередко к гибели эмбрионов и других организмов. Поэтому допустимые значения для прудовых хозяйств общего железа составляют не более 2,0 г/м3, закисного — не более 0,2 г/м3.
Методы изучения гидрохимического режима водоемов.Гидрохимический контроль по степени значимости подразделяют на оперативный, текущий и полный.
Оперативный анализ воды включает определение физических свойств воды (цветности, прозрачности, температуры), растворенного кислорода, диоксида углерода, активной реакции воды. Частота взятия проб на анализ и их количество зависят от категории водоема, его размеров. Так, в нерестовых, а также выростных и нагульных прудах в наиболее напряженный период (высокая температура воды, накопление большого количества органических веществ) пробы воды берут ежедневно, при нормальных условиях — раз в декаду, в зимовальных прудах — через 5—7 дней.
Для получения общей характеристики качества воды проводят краткий текущий анализ, который включает дополнительно к перечисленным выше определениям исследование окисляемое™, количества общего железа, сероводорода, аммиака, нитритов и нитратов. Его проводят один раз в 10 дней или один раз в месяц в прудах и водоисточниках.
Полный гидрохимический анализ проводят один раз в месяц или 1-2 раза в летний и зимний сезоны, а также при пересадках
рыбы на летнее и зимнее содержание. Он включает дополнительно к вышеперечисленным показателям исследование солевого состава (количество гидрокарбонатов, карбонатов, хлоридов, сульфатов, кальция, магния, фосфора), жесткости и щелочности, общего и закисного железа. Целью специальных исследований может быть определение тяжелых металлов и микроэлементов.
Оперативный анализ воды обычно проводят в лаборатории хозяйства, а текущий и полный — в специализированных гидрохимических или ветеринарных лабораториях.
При проведении гидрохимических исследований особое внимание следует обращать на отбор проб воды. Его следует выполнять, тщательно придерживаясь следующих основных правил: проба должна быть взята так, чтобы она отражала условия среды в водоеме; отбор проб, хранение и транспортирование не должны приводить к изменениям в содержании определяемых компонентов или в свойствах воды; объем пробы должен быть достаточным для определения всех намеченных компонентов (0,5—2,0 л).
Место для отбора пробы выбирают в соответствии с целью анализа. Вода озер, водохранилищ и больших по площади прудов неоднородна по своему составу, поэтому пробы отбирают на разных участках и с различных глубин в одних и тех же местах. На рыбоводных прудах должны быть определены стационарные точки для взятия проб воды.
В нерестовых прудах это может быть одна точка, в выростных и нагульных в зависимости от площади и конфигурации — обычно 2—4 точки.
При контроле за зимовкой рыбы пробы отбирают в головном пруду, в водопадающем канале, в зимовальных прудах, в месте подачи воды из канала и у водоспуска. При небольших глубинах водоема пробы отбирают под поверхностью и у дна (0,2—0,5 м от дна). Если водоем имеет значительную глубину, то пробы отбирают на стандартных горизонтах: 0,5; 2; 5; 10; 20 м и т. д.
Пробы воды для химического анализа отбирают с помощью специальных приборов — батометров (рис. 20). Существует несколько конструкций батометров. В основе батометра, изготовляемого из металла или органического стекла, лежит полый цилиндр, снабженный плотно прилегающими крышками. При погружении прибора в воду цилиндр открыт и вода свободно проходит через него. Когда батометр достигает заданной глубины, крышки закрывают и прибор поднимают на поверхность. Из батометра воду переливают в склянки с помощью резинового шланга.
Склянки предварительно должны быть тщательно вымыты, высушены и пронумерованы. Для определения растворенных в воде газов используют склянки с притертыми пробками. Для хранения и транспортирования проб воды на общий анализ применяют также полиэтиленовую посуду. При отсутствии батометра пробы можно отбирать в бутыль, которую опускают на заданную глубину с помощью специального приспособления, например шеста. Для умень-
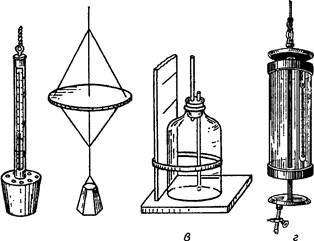
б
Рис. 20. Приборы для определения физических свойств и отбора проб воды: а — термометр; б—диск Секки; в — бутыль с шестом; г — батометр
шения перемешивания пробы воды с воздухом, находящимся в бутыли, в горлышко вставляют пробку с двумя трубочками, одна трубочка почти достигает дна, другая заканчивается сразу под пробкой (через нее из бутыли выходит воздух).
Пробы воды для определения кислорода помещают в специальные кислородные склянки и фиксируют сразу на месте отбора. Одновременно из батометра берут воду для определения СО2 и рН. После этого берут пробу воды на общий анализ.
Если нельзя провести химический анализ воды сразу или в день взятия воды, то пробу воды необходимо законсервировать, с тем чтобы избежать изменений в ее химическом составе. При этом сроки определений могут составлять 2—3 сут.
При проведении гидрохимических исследований особое внимание следует обращать на систематическую регистрацию всех этапов работы. В полевом дневнике следует отмечать дату, номер пруда и станции, глубину, с которой взята проба, номера склянок, температуру и прозрачность воды, а также метеорологические условия в момент взятия пробы. В лаборатории необходимо вести рабочий журнал, где фиксируют результаты исследований.
Дата добавления: 2016-01-07; просмотров: 6005;
