Определение кристалла. Типы кристаллических решеток
ЭЛЕКТРОПРОВОДНОСТЬ ПОЛУПРОВОДНИКОВ
КАК ЯВЛЕНИЕ ПЕРЕНОСА НОСИТЕЛЕЙ ЗАРЯДА
Монокристаллы полупроводников. Носители заряда в полупроводниках
Определение кристалла. Типы кристаллических решеток
Большинство полупроводников представляют собой кристаллические материалы. Кристалл может быть определен как вещество с упорядоченной периодической структурой. Благодаря этому, кристаллы обладают следующими свойствами.
1) Часто наблюдаются явно выраженные плоскости роста кристаллов. Эти плоскости могут дать ключ к раскрытию структуры кристаллов.
2) Часто наблюдаются четко определенные плоскости скалывания, вдоль которых кристалл наиболее легко разрушается под действием напряжений.
3) Кристаллы когерентно рассеивают рентгеновские лучи и электроны. Это означает, что рассеянные лучи выходят из кристалла в основном лишь в некоторых избранных направлениях. Поэтому наиболее распространенным способом изучения кристаллической структуры является рентгеноструктурный анализ.
 4) Анизотропия кристаллов заключается в том, что многие физические характеристики материала могут зависеть от направления, даже если образец совершенно гомогенен. К их числу относятся: электропроводность, диэлектрическая проницаемость, оптические константы, коэффициент Холла и теплопроводность. Перечисленные эффекты можно объяснить тем, что расстояния между атомами в кристалле в различных направлениях различны.
4) Анизотропия кристаллов заключается в том, что многие физические характеристики материала могут зависеть от направления, даже если образец совершенно гомогенен. К их числу относятся: электропроводность, диэлектрическая проницаемость, оптические константы, коэффициент Холла и теплопроводность. Перечисленные эффекты можно объяснить тем, что расстояния между атомами в кристалле в различных направлениях различны.
При описании кристаллических структур обычно используют следующие понятия:
а). Элементарная ячейка определена как наименьший параллелепипед, транслируя который вдоль трех независимых направлений, можно получить весь кристалл.
б). Постоянная (или параметр) решетки обычно определяется как длина элементарной ячейки вдоль одной из осей. Межатомное расстояние (не обязательно совпадающее с постоянной решетки) есть действительное расстояние между соседними атомами.
в). Кристаллографическими осями называются направления, определяемые ребрами элементарной ячейки. Для кубической, ромбической и тетрагональной систем эти оси взаимно перпендикулярны.
К числу наиболее важных кристаллических типов относятся следующие:
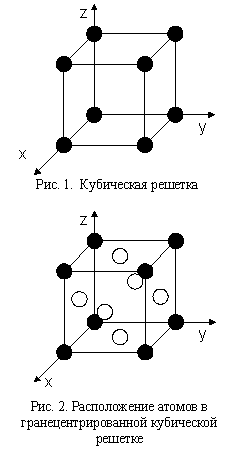
1) Простая кубическая решетка состоит из атомов, лежащих в углах куба (и нигде больше). Наиболее распространенным примером простого кубического кристалла является хлористый цезий CsCl. Элементарная ячейка в данном случае содержит один атом (рис. 1).
2) Гранецентрированная кубическая решетка более сложна, чем простая кубическая, т.к. в ней атомы расположены не только в вершинах куба, но и в середине каждой грани. Типичным представителем металлов такой структуры является алюминий. Элементарная ячейка содержит 4 атома (рис.2).
3) Кроме этих сравнительно простых структур есть еще ряд других, более сложных, но также с кубической элементарной ячейкой. Наиболее важной из них является решетка типа алмаза, в которой кристаллизуются, помимо самого алмаза, также полупроводники кремний и германий. Проекция на грань куба такой элементарной ячейки изображена на рис. 3. Основную роль здесь играет наличие тетраэдрических связей: каждый атом имеет четырех ближайших соседей, связанных с ним валентными связями. Решетка алмаза представляет собой модификацию гранецентрированной кубической и состоит из двух гранецентрированных решеток, сдвинутых одна относительно другой на одну четверть постоянной решетки.
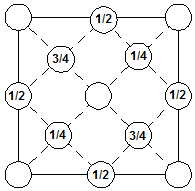
Рис. 3. Проекция решетки типа алмаза на грань куба
(ребро ячейки принято за единицу).
В решетке типа алмаза ребра элементарной ячейки не совпадают с направлениями валентных связей. Следует отметить, что определение элементарной ячейки связано лишь с возможностью воспроизвести все атомы в кристалле путем соответствующей трансляции ребер ячейки.
Дата добавления: 2015-12-16; просмотров: 1806;
