Фотохимические реакции
Фотохимические реакции - реакции, которые происходят под действием света, или более точно: фотохимические реакции - это такие, в которых используется энергия электромагнитных колебаний для инициирования реакции. Это может быть видимый свет, УФ или ИК излучение. (Примеры: реакции фотосинтеза, процессы, происходящие при фотосъемке, явление люминесценции, обесцвечивание красителей)
Фотохимические реакции могут быть классифицированы на 2 группы:
1. Реакции, которые могут происходить термодинамически без участия света (например, реакция H2+Cl2 = 2HCl) В таких случаях свет является инициатором реакции, помогая преодолевать энергетический барьер или уменьшая энергию активации. Такие процессы часто называют фотокаталитическими.
2. Реакции, которые термодинамически не могут происходить в данных условиях и для них требуется работа работа внешних сил (источник).
В каждой фотохимической реакции необходимо различать первоначальную стадию, которая непосредственно вызвана действием света и другие последующие стадии, которые могут проходить без действия света.
Связь между количеством поглощенной энергии и количеством вещества которое подверглось превращению под действием этой энергии выражается законом фотохимической эквивалентности, установленного А.Эйнштейном: каждая молекула, прореагировавшая под действием света приняла один квант излучения.
N= 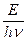
гдe N - количество прореагировавших молекул,
E - количество световой энергии, поглощенной веществом,
n - частота излучения, с-1
h – константа Планка;
hn - энергия кванта
Катализ
Катализ -это явление в котором определенные вещества, называемые катализаторами, изменяют скорость или инициируют реакцию, но сами они участвуя в реакции в конце остаются химически неизменными.
Катализ, в котором катализатор ускоряет реакцию называется положительным, в котором замедляет реакцию - отрицательным (ингибитором). Реакции, которые каталитически ускоряются благодаря своим собственным продуктам называются aвтокаталитическими.
Гомогенный катализ - когда катализатор находится в таком же агрегатном состоянии как и реагенты (газ-газ, жидкость в смеси жидкостей). В гетерогенном катализе катализатор присутствует как другая фаза, и реакция происходит на его поверхности.
Катализаторы не влияют на состояние равновесия данной реакции, но только облегчают или затрудняют его установление.
Катализаторы часто проявляют высокую специфичность. Это означает, что часто они предпочтительно ускоряют только одну из нескольких возможных реакций для данных реагентов.
Пример:
Al2O3
 C2H5OH C2H4 + H2O
C2H5OH C2H4 + H2O
H3PO4
 2C2H5OH (C2H5)2O + H2O
2C2H5OH (C2H5)2O + H2O
Cu, Ni
 C2H5OH CH3CHO + H2O
C2H5OH CH3CHO + H2O
Дата добавления: 2015-11-04; просмотров: 715;
