Реакции первого порядка
Кинетическое уравнение реакции первого порядка имеет вид:
v = - 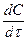 = kC
= kC
гдe c - концентрация реагента.
Преобразовав уравнение, получим:
- 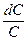 = kdt
= kdt
и после интегрирования:
lnC = -kt +B
Обозначив начальную концентрацию как Co (когда t=0) можно определить константу интегрирования B: B = lnC0
Далее:
lnC = -kt + lnC0 Þ (подставив lnC0) lnC - lnC0 = -kt Þ ln 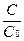 = -kt
= -kt
или (если найти антилогарифм): 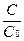 =exp(-kt) and C= C0×exp(-kt)
=exp(-kt) and C= C0×exp(-kt)
Диаграмма, где концентрация реагента представлена на оси ординат, время реакции - на оси абсцисс:
С
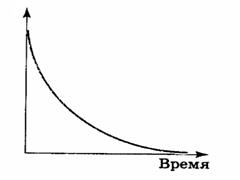
Представим, что нужно определить время, когда C= C0/2 (концентрация исходного вещества упадет в 2 раза)
ln 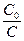 = ln2 = -kt, t=
= ln2 = -kt, t= 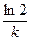 =
= 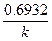
Эта зависимость показывает, что константа скорости реакции 1-го порядка обратно пропорциональна времени (периоду) полураспада.
Период полураспада (t1/2) равен времени, в течение которого прореагирует половина первоначального количества вещества.
Также можно получить подобные уравнения для (t1/2) для реакций более высокого порядка, но это более сложно.
Порядок реакций не равен их молекулярности если :
a) Один из реагентов присутствует в таком большом избытке, что его расход практически не будет изменять его концентрацию. Например, гидролиз эфира в разбавленном водном растворе:
CH3COOC2H5 + H2O = CH3COOH + C2H5OH
Концентрация воды изменяется пренебрежимо мало, и скорость реакции будет зависеть только от изменения концентрации эфира. В результате скорость реакции будет описываться уравнением 1-го порядка, хотя это бимолекулярная реакция.
b) Если это сложная реакция. Обычно в этом случае уравнение химической реакции отражает только общий эффект всех взаимодействий
Например: 2N2O5 ® 4NO2 + O2
Молекулярность равна 2. Реакция имеет 2 стадии:
N2O5 ® N2O3 + O2 (1)
N2O3 + N2O5® 4NO2 (2)
1-я стадия - медленнее и определяет скорость суммарной реакции, поэтому v=kCN2O5 и порядок реакции равен 1. Если одна из стадий проходит при низкой, по отношению к другим, скорости, то суммарная скорость реакции будет определяться скоростью этой стадии. Эта стадия называется - лимитирующая стадия реакции.
c) Для гетерогенных реакций, например:
2Zn + O2 = 2ZnO. Молекулярность реакции равна 3, но кинетика реакции описывается уравнением реакции 1-го порядка: v= k×CO2,
потому что Zn - это твердое вещество, у него нет концентрации, но O2 - газ, ему соответствует определенная концентрация.
Сложные реакции
Кинетика сложных реакций, состоящих из 2-х и более простых реакций, взаимосвязанных друг с другом тем или иным способом, зависит от природы этой взаимосвязи и отношения скоростей простых реакций. Типичные формы взаимосвязи простых реакций, когда они являются параллельными, последовательными (консекутивные), сопряженными и обратимыми реакциями.
Теория кинетики сложных реакций основана на принципе, что когда несколько реакций происходят одновременно и каждая идет независимо и кинетика каждой реакции может быть описана кинетическим уравнением простой реакции.
Параллельные реакции - это реакции вида:
A ®B
¯
C
В таких реакциях начальное вещество (или вещества) могут реагировать параллельно в различных направлениях.
Например, 6KClO3 ® 2KCl + 3O2
¯
3KClO4 + KCl
Последовательные реакции -реакции вида:
k1 k2
A ® B ® C
где B - промежуточный продукт в образовании C и k1 и k2 - константы скорости 2-х стадий реакции.
Сопряженные реакции - реакции типа:
A + B ® M
A + C ® N,
В которых одна, например 1-я, происходит только вместе со 2-й, т.е. индуцируется 2-й.
Обратимые реакции. Скорость обратимой реакции равна разности между скоростями прямой и обратной реакций.
Например:
v1
H2 + J2 Û 2 HJ
v2
v = v1 - v2 ,
если написать выражения для скоростей прямой и обратной реакций:
v1 = k1CH2CJ2
v2 = k2C2HCl
Если в системе первоначально присутствуют только реагенты (H2 и J2), скорость прямой реакции v1 (Исходные вещества) будет уменьшаться с уменьшением концентраций этих компонентов.
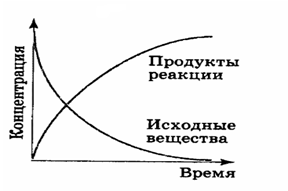
Кривая v2 (Продукты реакции) начинается в начале координат (поскольку по условию первоначально CHJ = 0) и возрастает по мере того, как реакция идет.
Положение равновесия будет достигнуто, когда абсолютное значение скоростей прямой и обратной реакций будет равным: v1 = v2 и результирующая скорость = 0.
Если переписать соотношение и затем преобразовать его:
k1CH2CJ2 = k2C2HCl
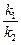 =
= 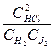 = Kc
= Kc
где Kc - концентрационная константа равновесия реакции.
Если предыдущее уравнение применять к реакциям, проходящим в не очень разбавленных растворах, мы должны заменить концентрации веществ их активностями, и тогда заменить Kc на Ka.
Если уравнение применять к смеси идеальных газов мы должны заменить концентрации - парциальными давлениями газов, и соответственно Kc на Kp:
Kp= 
гдe pHCl, pH2, pJ2 - парциальные давления газов. Парциальное давление газа, находящегося в смеси других газов, равно давлению, которое этот газ производил, если бы он при данной температуре занимал весь объем, занимаемый смесью газов. В общем случае Kp ¹ Kc. Если применить уравнение для идеальных газов, можно найти зависимость между Kp и Kc.
pi = 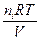 = Ci RT
= Ci RT
где ni - количество молей газообразного компонента i, Ci - концентрация газа.
Tогда для вышеприведенной реакции:
Kp= 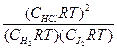 = Kc (RT).
= Kc (RT).
В общем случае: Kp = Kc (RT)Dn ,
гдe Dn -разность между стехиометрическими коэффициентами газообразных продуктов реакции и реагентов (Для реакции (H2 and J2) Dn=0 and Kp = Kc)
Константа равновесия - важная характеристика реакции, по ее величине можно судить о степени протекания реакции (большое значение - реакция сдвинута в сторону продуктов реакции, низкое - в сторону исходных веществ). Константа не зависит от концентраций (давлений), зависит от температуры.
Если переписать уравнение реакции в общем виде:
aA + bB = cC + dD +eE
и вещества A, B, C and D - газы, а E - жидкость или твердое вещество, тогда:
Dn= c + d –a –b
Для условий: реакция проходит при постоянной температуре и постоянных парциальных давлениях для всех веществ, и законы идеальных газов применимы, существует связь между энергией Гиббса и константой химического равновесия Kp:
DGochem r. = -RTlnKp,
Таким образом, можно вычислить значение Kp
Дата добавления: 2015-11-04; просмотров: 3632;
